동양인은 서양인보다 전립선암이 적게 생기지만 부검을 통해 확인되는 미세 전립선암 유병율은 비슷합니다. 그러므로 동서양 차이는 암 발생보다 진행 속도의 차이로 보는 것이 합리적입니다. 특히 미국으로 이주한 동양인의 전립선암 진단율이 서구인과 비슷해진다는 점은 식이요법을 통해서 전립선암 진행을 효과적으로 억제할 수 있다는 것을 의미합니다.
저위험군 전립선암 환자에서 수술과 방사선치료 등 침습적 치료 여부에 따른 생존율 차이가 거의 없다는 것이 밝혀짐에 따라 정기적인 모니터링과 함께 치료를 유예하는 적극적 관찰치료(active surveillance)를 선택하는 환자가 증가하고 있습니다. 한 걸음 더 나아가 식이요법과 대사관련 약물치료를 통해 암의 진행을 적극적으로 차단하는 예방적 관찰치료(proactive surveillance)는 우리 개원의사가 참여하기 유리한 분야라 하겠습니다.
전립선암 대사(metabolism)의 특징
효과적인 식이요법이란 암이 우선적으로 필요한 영양소를 선택적으로 제한하는 것입니다. 전립선암에게 꼭 필요한 영양소는 무엇 일까요? 올해 2월 Science 자매지에 실린 한 연구는 전립선암의 대사 특징을 명확히 설명합니다 [1]. 전립선암은 지방을 많이 흡수하고, 다른 영양소를 이용해서 지방을 합성하며(de novo lipogenesis), 지방을 에너지원으로 사용하지 않고 인산지방산으로 저장합니다. 악성도가 높을수록 이러한 경향은 더욱 뚜렷합니다. 전립선암 대사적 특징은 지방산의 흡수, 생성 및 저장입니다.
전립선암이 진행하는 과정도 지방과 관련해서 살펴보면 흥미롭습니다. 전립선 주변 지방조직(preprostatic fat)은 암의 침윤이 최초로 시작되는 곳입니다. 전립선암은 주로 임파관을 통해 전이합니다. 우리가 섭취한 영양소 중에서 탄수화물과 단백질이 간정맥을 통해 일차적으로 간에 흡수되는데 반해서 지방은 간을 우회해서 임파관을 통해서 이동합니다. 가슴림프관팽대(Cisterna chyli)는 소장에서 흡수된 싱싱한 지방이 일차로 모이는 집합 장소입니다. 임파관은 전립선암이 이 곳으로 오는 최단 코스입니다. 전립선암은 주로 임파선과 뼈로 갑니다. 임파선 주변과 골수에는 지방 조직이 풍부합니다. 노인 골수에는 지방이 많아 황색골수(yellow marrow)라고 합니다. 지방세포는 adipokine을 분비해서 전립선암 세포를 유인한다고도 합니다. 비만은 전립선암 사망률과 비례합니다.
저지방식이 전립선암 환자에게 이로운 것은 확실합니다. 그런데 포화지방산이 많은 동물성 지방은 나쁘고 불포화지방산이 많은 식물성 지방은 괜찮다고 합니다. 암에 좋다는 오메가 3 지방산이 풍부한 생선기름이 오히려 전립선암 사망률을 높인다고 해서 논란이 된 적도 있습니다. 어떤 지방산이 나쁜가요? 논문을 찾아봐도 뚜렷한 근거를 찾기 어렵습니다. 체지방을 줄이는 것이 유리하다는 공통된 결론을 넘어 세부적인 각론으로 들어가면 서로 상반된 주장들이 다양합니다.
Alpha methylacyl CoA racemase(AMACR)
2000년 미국 워싱턴 대학 Xu 박사는 subtraction and microarray라는 신기술을 이용해서 전립선암에서만 발현되는 새로운 단백을 찾아내 P504S로 명명하였습니다 [2]. 안타깝게도 새로운 물질은 아니었는데 P504S는 희귀 유전병의 원인으로 알려진 alpha methylacyl CoA racemase (AMACR)이었습니다. 그렇다고 이들의 성과가 퇴색한 것은 아닙니다. AMACR이 전립선암에서 과발현 된다는 것을 최초로 규명함으로써 전립선암 병리 진단에 획기적인 전기를 마련했기 때문입니다.
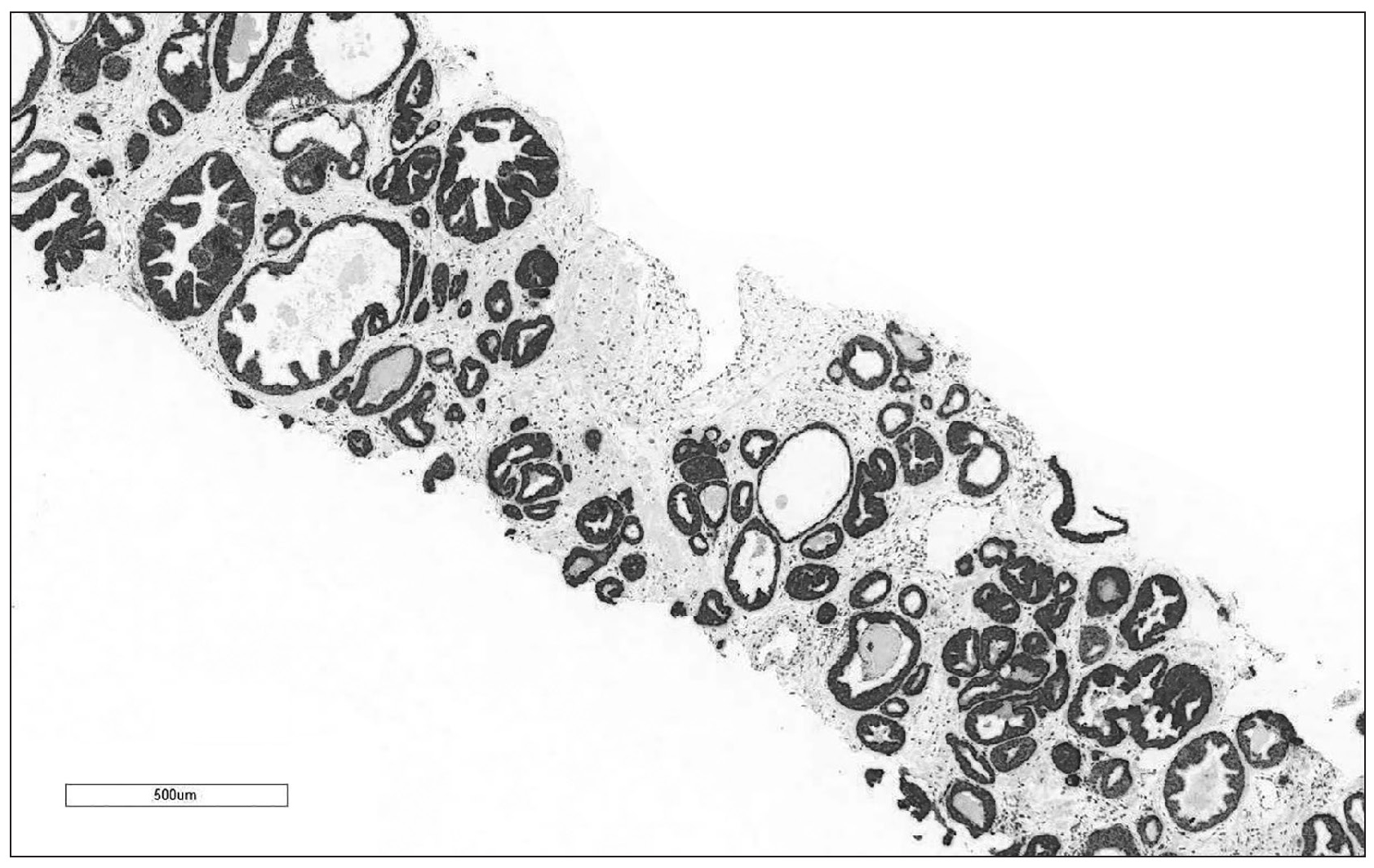
전립선암 중에 98%는 AMACR를 만들고 정상 전립선 세포는 만들지 않습니다. 그래서 AMACR는 전립선암을 확진하는 면역화학염색에 이용합니다(그림 1). AMACR 생성은 남성호르몬이나 성장인자의 영향도 받지 않습니다. 마치 해병대의 붉은 명찰처럼 전립선암과 AMACR의 관계는 절대적입니다.
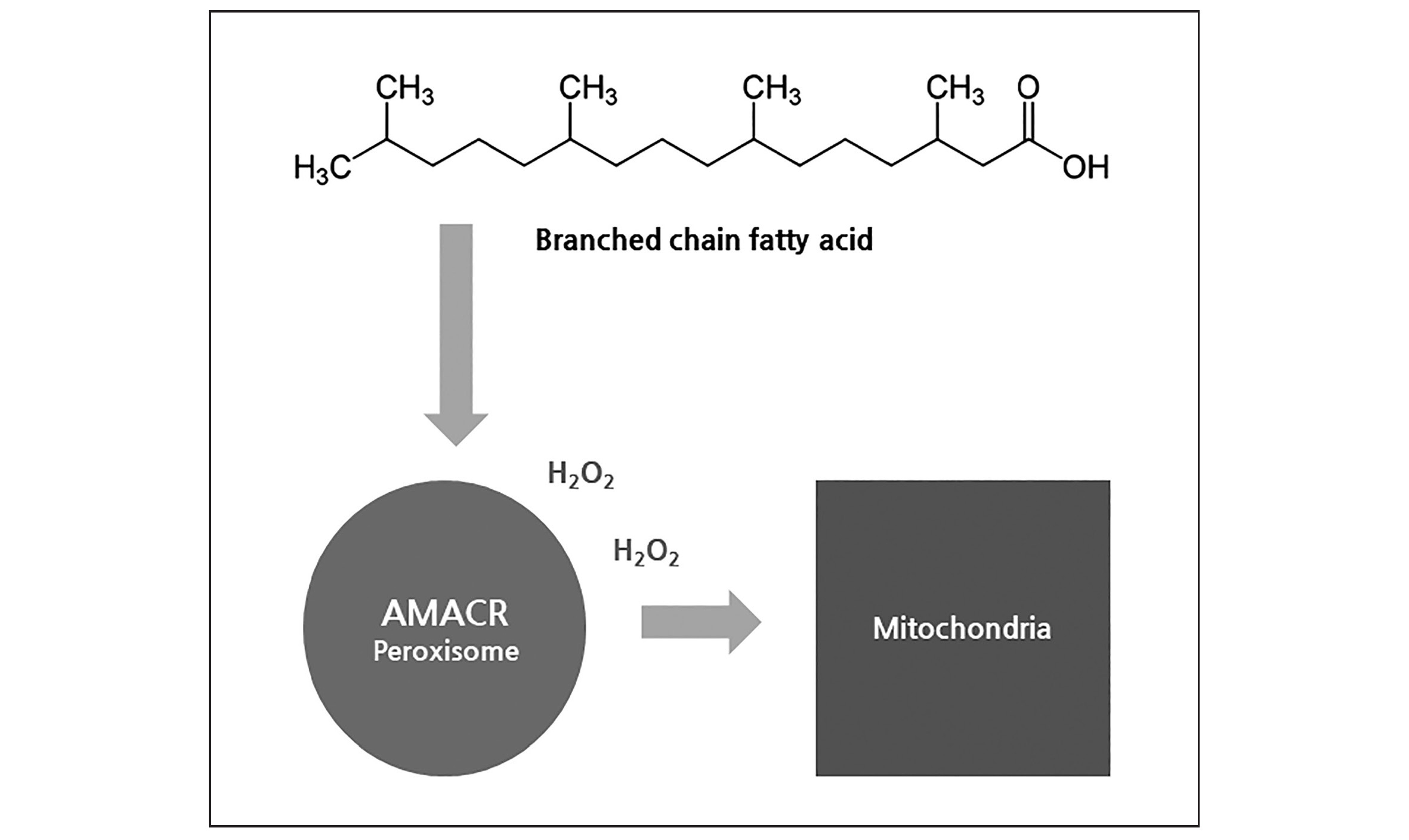
AMACR은 가지지방산(branched chain fatty acid) 대사에 관여합니다. 원래 지방산은 탄소 원자가 한 줄로 연결된 구조로 미토콘드리아에서 대사되는데 가지지방산은 peroxisome이라는 세포소기관에서 일차적으로 가지를 떼어낸 다음에 미토콘드리아로 전달됩니다. AMACR이 바로 지방산에 달려있는 탄소 가지를 떼어내는 역할을 맏고 있습니다. 이 과정에서 과산화수소(hydrogen peroxide)가 많이 만들어져 peroxisome이라고 불립니다. 즉 가지지방산은 탄소가 농축된 효율적인 에너지원이기는 하지만 대사과정에서 활성산소가 만들어지는 나쁜 지방산입니다 (그림 2). 세포를 자동차로 본다면 가지지방산은 가짜 휘발류에 해당합니다. 정상 세포와 달리 자살 능력을 상실한 암세포에게 활성산소는 유전자 돌연변이를 축적시켜 악성화를 촉진합니다.
간과 신장을 제외하면 AMACR를 만드는 세포는 없습니다. 전립선암은 왜 이 물질을 만들까요? 정확한 답을 찾을 수는 없었습니다. 우리가 모르는 중요한 재료로 쓰일 가능성도 있습니다. 이유가 어찌되건 결과적으로 가지지방산은 전립선암의 에너지원으로 이용될 뿐만 아니라 그 대사과정에서 활성산소를 발생 시킴으로써 암의 악성화에 기여하는 것으로 판단됩니다.
Refsum 식이요법
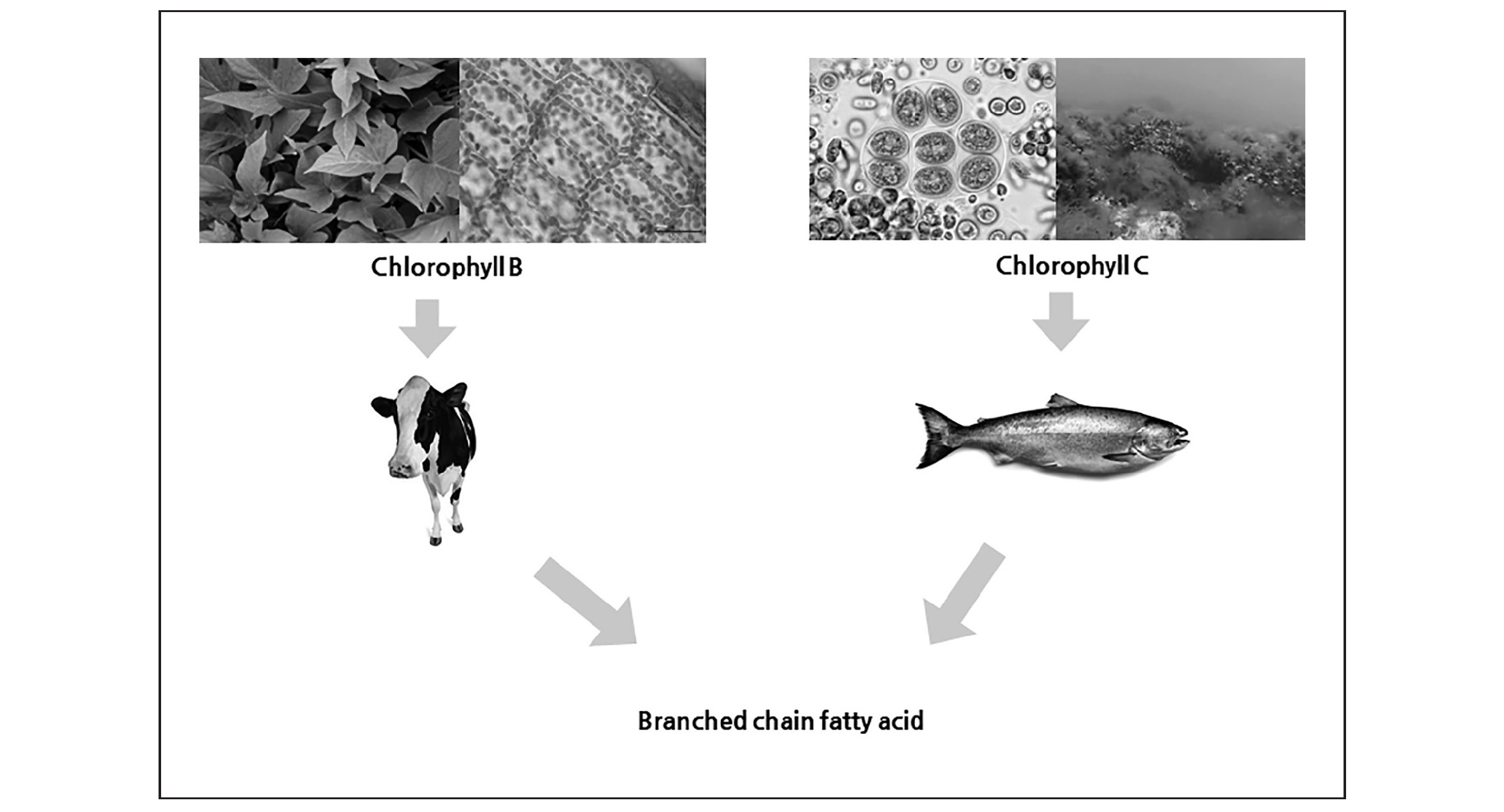
노르웨이 베르겐 대학 신경과 Sigvald Refsum 교수는 1949년 특징적인 신경계 증상을 나타내는 희귀한 유전병을 보고하였습니다 [3]. 시각, 청각, 후각 뿐만 아니라 운동 기능이 서서히 사라져 30대 전에 사망하는 끔찍한 이 질환을 Refsum씨병이라 불렀습니다. 수십년이 지나서야 혈액과 조직에 있는 가지지방산 농도가 높다는 것이 밝혀졌습니다. AMACR을 비롯한 가지지방산 대사에 필요한 효소 결핍이 원인이었습니다. Refsum씨병이 유명한 이유는 초기에 진단되면 식이요법만으로 치료할 수 있다는 점 때문입니다. 가지지방산은 엽록소를 구성하는 지방산입니다. 인간은 엽록소가 포함된 채소나 해조류로부터 가지지방산을 직접 흡수하지 못합니다. 풀을 뜯어 먹는 반추 동물이나 해조류를 먹는 기름진 생선을 통해 간접적으로 들어옵니다. 가지지방산의 섭취를 제한하는 철저한 식단이 생사를 가르는 유일한 치료방법이라 Refsum씨병에 대한 식이요법은 매우 자세하게 정립되어 있습니다.
구체적인 식단을 살펴보겠습니다 (표 1) [4]. 앞서 설명한대로 가지지방산은 엽록소로 부터 유래된 지방산이라서 풀과 녹조를 먹는 동물을 통해서 간접적으로 흡수됩니다 (그림 3). 그러므로 소, 양, 염소와 같은 반추동물, 특히 방목해서 기르는 유기농 소에 많습니다. 축사에서 옥수수로 만든 압축사료를 먹고 자란 소는 상대적으로 적다고 합니다. 우유를 비롯한 치즈, 요거트, 크림, 버터 등 유제품과 고등어, 광어, 연어와 같은 기름진 생선에 많이 함유되어 있습니다. 특히 오메가 3 지방산이 풍부해서 전립선암에 좋다는 생선기름은 가지지방산 농축액입니다. 반대로 각종 곡물, 야채, 과일, 콩, 두부 등 전립선암에 좋다고 알려진 음식과 계란이나 곡물 사료를 먹는 돼지와 닭, 대구, 게, 새우 등 기름기 없는 해산물에는 가지지방산이 별로 없습니다.
Table 1. 음식별 가지지방산 함유량
| 가지지방산 (mg/100g) | |
| 생선기름 | 753 |
| 쇠고기 (유기농) | 325 |
| 버터 | 177 |
| 연어 | 255 |
| 치즈 | 129 |
| 고등어 | 40 |
| 쇠고기 | 33 |
| 우유 | 10 |
| 요거트 | 7 |
| 대구 | 5 |
| 광어, 가자미 | 5 |
| 게 | 2 |
| 새우 | 1 |
| 돼지고기, 햄, 닭고기, 오리고기 | 0 |
| 무지방 우유 | 0 |
| 쌀, 아채, 과일 | 0 |
| 콩, 두부, 두유, 된장 | 0 |
| 계란 | 0 |
통계마다 다소 차이는 있으나 전립선암 유병률이 가장 높은 나라는 뉴질랜드, 가장 낮은 나라는 인도입니다. 뉴질랜드는 방목하여 기른 유기농 소를 대대적으로 홍보하는 나라입니다. 유기농 지표로 활용하는 것이 바로 가지지방산 함유량입니다. 인도는 종교적 이유로 소를 먹지 않습니다.
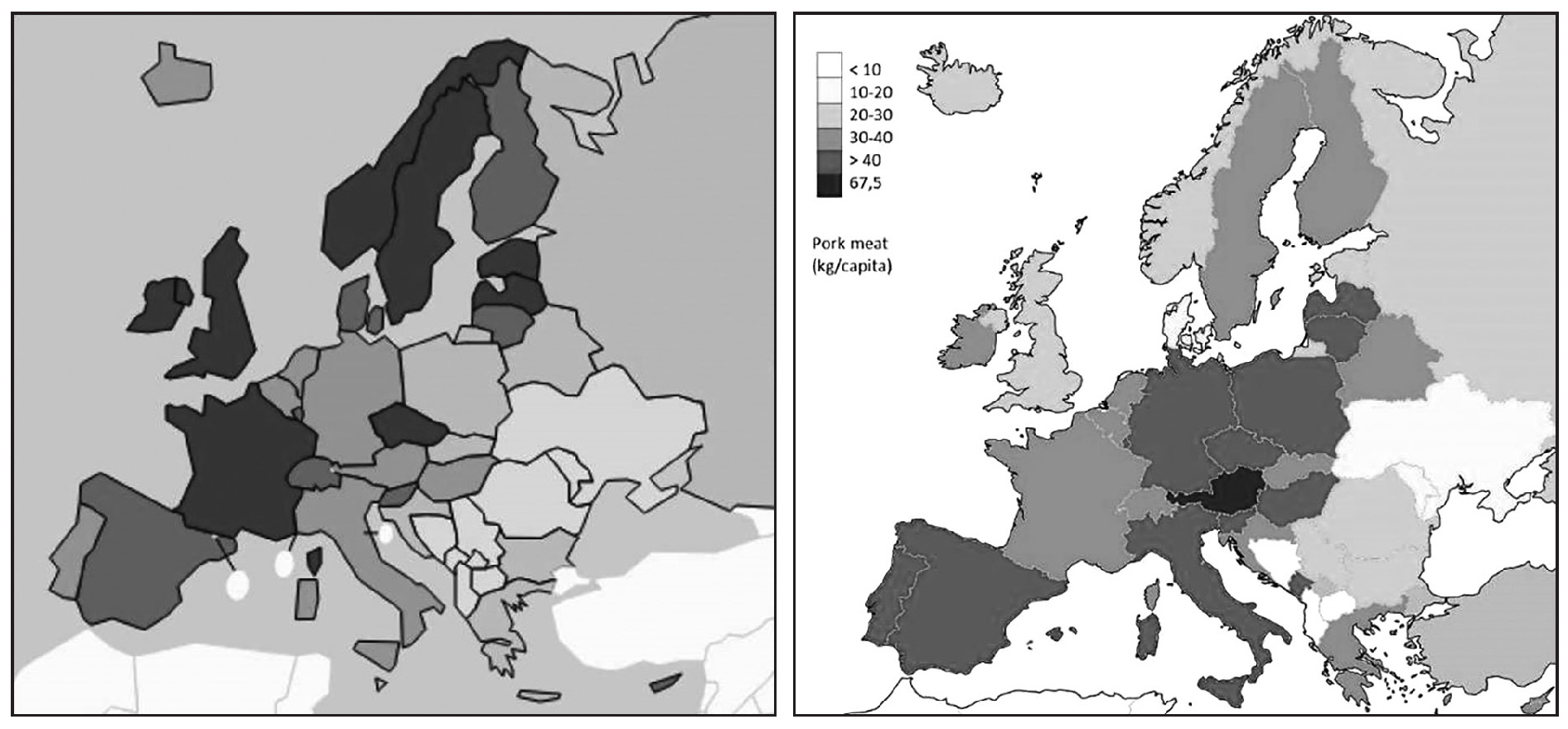
쇠고기와 돼지고기를 구분해서 전립선암과 상관관계를 분석한 연구는 찾지 못했습니다. 돼지고기를 많이 먹는 나라는 전립선암이 별로 없는 중국을 포함한 아시아권 나라들입니다. 인종 차이가 별로 없는 유럽으로 시야를 좁혀도 돼지고기 소비량은 전립선암 발생율과 오히려 반비례하는 것처럼 보입니다 (그림 4). Refsum 박사의 모국인 노르웨이는 선진국 임에도 불구하고 전립선암 사망률이 높은 나라입니다. 노르웨이는 전 세계 연어 공급량 90%를 생산하고 가장 많이 소비한다고 합니다. 2012년 발표된 한 전향적 연구에 의하면 가지지방산 섭취량이 많을수록 진행된 전립선암이 많았습니다 [5].
엽록소로 부터 유래된 가지지방산은 전립선암에 에너지를 제공할 뿐만 아니라 악성화를 촉진시키는 불량 영양소입니다. 반세기 넘게 철저히 정립된 Refsum씨병에 대한 식이요법은 가지지방산 섭취를 효과적으로 제한하는 방법을 명확히 제시합니다. 아무리 효과적인 식이요법이라도 실천하기 힘들면 소용 없습니다. 음식 양이 아니라 종류를 가려 먹는 식단은 지키기도 수월합니다. 비록 확립된 정설이 아니고 필자가 지난 몇 개월간 찾아낸 조각들을 끼워 맞춘 지극히 개인적인 제안에 불과하지만 진위 여부는 후학들에게 미루고 여러분과 공유하고자 합니다. 인간은 영장류 중 유일하게 식물로부터 가지지방산을 직접 흡수하지 않도록 진화했습니다. 전립선암은 차치하더라도 오랜 진화에 역행하는 식습관은 현명하지 못할 겁니다.