1. 서론
전립선특이항원 (Prostate Specific Antigen, PSA)은 전립선암을 조기 진단하기 위해 사용되는 바이오마커이며, 이 PSA를 이용한 선별검사는 전립선암을 조기에 발견하여 수술이나 방사선 치료 등을 시행하여 사망률을 낮추었다. 하지만, PSA 검사의 전립선암에 대한 진단 특이도는 매우 낮아서, PSA 회색지대 (grey zone, PSA: 3-10 ng/ml)에서 조직검사 후의 전립선암 양성률이 15-30%에 불과하여 불필요한 조직검사가 많이 이루어지고 있는 상황이다. 이러한 특이도가 낮은 PSA 검사의 단점을 극복하기 위해 전립선암을 진단하는데 높은 민감도와 특이도를 가진 여러 방법들이 개발되어 세계적으로 사용되고 있고, 이 중 국내에 도입되어 사용되고 있는 Beckman coulter사의 prostate health index (PHI) 검사를 소개하고자 한다.
2. 본론
전립선암은 서구에서 가장 흔한 남성암이고, 우리나라는 서구보다는 낮은 발생률을 보이지만 그 발생률이 증가하고 있다. 국가암정보센터 통계에 따르면 전립선암은 2017년 12,797명의 신환이 발생하여 한국 남성암 중 4위를 차지하였다 [1]. PSA 도입으로 전립선암을 조기에 진단하는 비율이 크게 늘었지만, PSA는 전립선암 특이 항원은 아니어서, 전립선비대증, 전립선염, 손상이나 전립선 생검 및 마사지 등에 의해서도 상승 할 수 있다. PSA 수치가 회색지대 (3-10 ng/ml)에 있을 경우, 전립선암이 있을 확률이 약 15-30% 정도여서 이를 확인하기 위하여 전립선 생검을 시행하지만, 다른 요인으로 PSA가 상승된 환자들은 불필요하게 침습적 시술인 전립선 생검을 시행받는다 [2]. 이러한 특이도가 낮은 PSA 검사의 단점을 극복하기 위해 전립선암을 진단하는데 높은 민감도와 특이도를 가진 여러 다른 방법들이 개발되었고, PSA가 전립선 조직 특이 항원이므로 그 유도체에서 찾고자 하는 노력이 있었다.
PSA는 전립선 상피세포에서 분비되는 세린계 단백질분해효소이며, 보통은 정액으로 분비되어 정액을 액화시켜 정자의 운동성을 증가시키는 역할을 하는데, 암일 경우 혈액으로 흘러들어가게 된다. 혈중의 PSA는 대부분 단백질분해효소억제제와 결합된 형태로 존재하는데, 일부 유리 PSA가 전립선암과 연관성이 있다는 보고 하에 전체 PSA 중 유리 PSA의 비율을 구하는 유리 PSA% (% free PSA)를 이용하여 전립선암의 가능성을 확인하지만, 임상적 유용성이 충분하지 않은 것으로 알려져 있다.
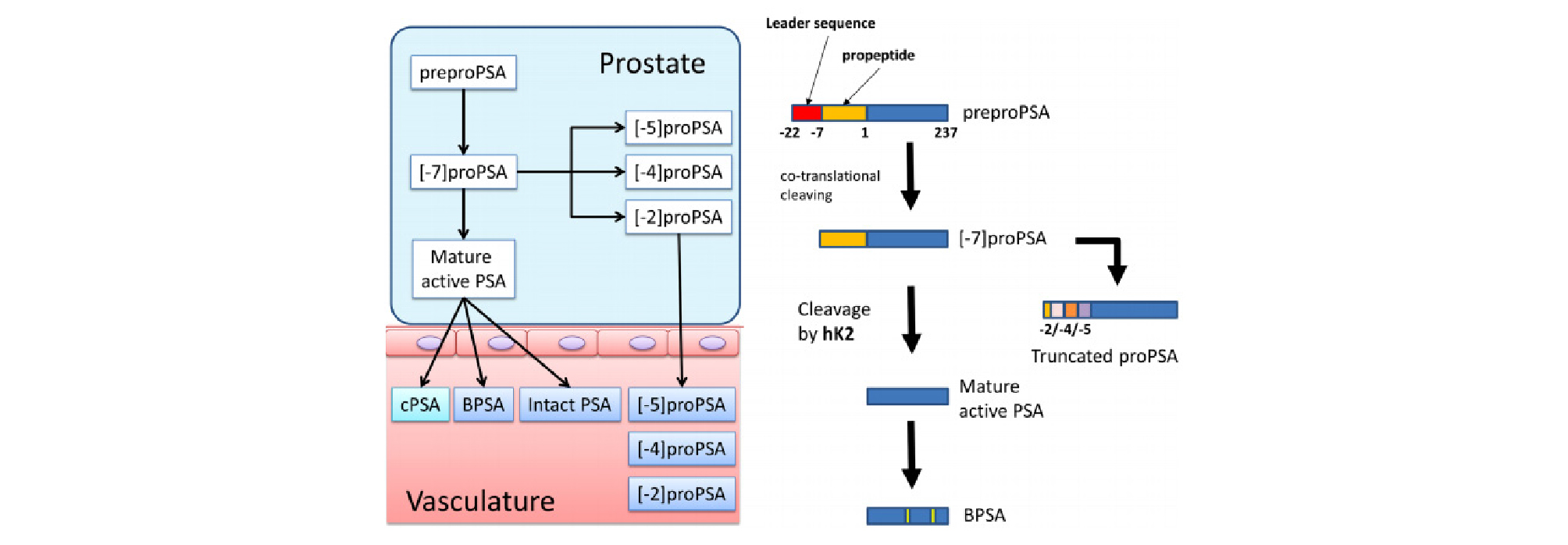
PSA는 여러 가지 분자형태로 존재하는데, 전립선 세포에서 PSA 단백질 서열 앞에 프리서열 (presequence)과 프로서열 (prosequence)가 붙어있는 형태 (preproPSA)에서 프리서열이 잘려나가면 7개의 아미노산으로 이루어진 프로서열이 붙어있는 PSA (proPSA)가 만들어진다 [3], [그림 1]. 프로서열에서 잘리는 아미노산 부위에 따라서 여러 가지 절단된 단백질 아형 ([-2]proPSA, [-5]proPSA, and [-7]proPSA)이 만들어지는데, 이 중에서 [-2]proPSA (p2PSA)는 다른 아형에 비해 안정적이고, 전립선암에서 높은 발현율을 보인다 [4,5]. 이 결과에 근거하여 Beckman coulter사에서는 전립선암에서 발견되는 여러 바이오마커들, 즉 PSA, freePSA, p2PSA의 조합으로 산출된 prostate health index (PHI=(p2PSA/fPSA)×√PSA)) 검사를 개발하였다.
PHI 검사는 2012년 FDA 승인을 받은 이후, 전립선암이 의심되는 환자에서 전립선암에 대한 위험도 정보를 제공하여 전립선 생검 진행 여부를 결정하는데 도움을 주는 검사로 임상에서 유용하게 사용되고 있다. 전립선암이 의심되는 환자를 대상으로 전립선암에 대한 민감도를 90%로 고정하였을 때, PHI 검사는 PSA 검사보다 3배 높은 특이도를 보였으며, 이로 인해 약 30%정도의 불필요한 전립선 생검을 줄이는 효과를 보였다. 낮은 PHI 수치는 전립선암에 대한 확률이 낮음 (PHI 27이하, 전립선암 가능성 9.8%)을 의미하며, 높은 PHI 수치는 전립선암에 대한 가능성이 높음 (PHI 55이상, 전립선암 가능성 50.1%)을 의미한다.
PHI 검사는 2014년 처음으로 NCCN 지침의 권고사항에 들어갔으며 [6], 이 때에는 PSA가 상승된 환자에서 전립선암을 확인하기 위한 다음 단계로 전립선암 생검, PSA/DRE로 6-12개월 추적 혹은 유리 PSA, PHI 혹은 PCA3로 추적할 것을 권고하여, 생검과 같은 단계에서 취할 수 있는 방법으로 권고되었다. 그러나 2017년 NCCN 지침에서는 전립선암 생검을 진행하기 전에 전립선암에 대한 위험도를 측정하는 도구로 유리 PSA, 4K score 혹은 PHI를 사용할 것을 권고하였다 [7]. 이를 통해 PSA 수치가 상승되어 전립선암이 의심되는 환자에게서 PHI 검사를 통해 전립선암에 대한 위험도를 한 번 더 확인 후 침습적인 전립선 생검을 시행하여 불필요한 생검을 줄이고자 하였다. 이러한 내용은 유럽가이드라인에서도 PSA가 회색지대로 상승된 경우 전립선 생검 전 단계에서 전립선암에 대한 위험도를 측정하는 도구로 사용할 것을 동일하게 권고하고 있다 [8]. 우리나라에서는 2017년 PHI를 신의료기술 (보건복지부고시 제2017-186호)로 인정하였고, PHI 검사가 PSA 검사에서 전립선암이 의심되는 환자에서 다른 검사 (PSA, 유리 PSA)보다 전립선암에 대한 특이도가 높아 진단 정확성이 우수하며 전립선암 진단에 대한 예측 정확성이 유의하게 향상되어 불필요한 전립선 조직검사를 감소시키고, 비침습적 검사방법으로 전립선암 및 고위험 전립선암을 검출할 수 있다는 점에서 안전성과 유효성을 인정받았다 [9]. 현재 우리나라 병원들에서도 2018년부터 도입을 시작하였으며, 2019년에는 2018년보다 4배 이상으로 검사건수가 증가하여 앞으로 검사건수는 증가될 것으로 예상된다.
PHI 검사의 임상적 유용성은 PSA 회색지대에서 진단적 가치, 수술 후 예후 예측 및 적극적 관찰 (Active surveillance) 환자에서 질환 진행 평가에 사용되고 있다. 여기에서는 개원의의 주된 관심사인 PSA 회색지대에서 진단적 가치에 대해 추가 설명하겠다.
2010년 초반에 PHI 검사가 전립선암이 의심되는 환자에서 PSA 검사보다 전립선암에 대한 높은 농도곡선하면적 (PSA AUC=약 0.5, PHI AUC=약 0.7)을 보인 많은 논문들이 발표되어 그 유용성을 인정받았다 [10,11]. 또한, 높은 PHI 수치는 전립선암에 대한 가능성이 높을 뿐 아니라 고위험군 전립선암일 가능성이 높다는 논문들이 발표되었다 [12,13]. 암을 진단할 때 하나로 완벽하게 진단할 수 있는 바이오마커는 없기 때문에, 전립선암 위험도 계산 시 여러 가지 위험 변수 (나이, 인종, DRE, PSA, 이전 생검 결과 등)를 넣은 다변수분석을 이용하는데, 기존의 변수에 PHI 검사를 추가하였을 경우 전립선암 예측정확도가 향상된다는 논문들이 발표되면서 [14] 유럽에서 사용하고 있는 European Randomised Study of Screening for Prostate Cancer (ERSPC) risk calculator 는 PHI 결과를 넣어서 전립선암 위험도를 계산하고 있다.
PHI 검사의 기준치 관련하여서는, NCCN 지침에서 고등급 전립선암의 가능성을 확인하는 기준치를 35 이상으로 제시하였지만, 발표된 논문들마다 전립선암에 대한 민감도와 특이도에 대해 서로 다른 최적의 기준치를 발표하고 있다. 2019년 발표된 유럽과 아시아인을 대상 (유럽인 800명, 아시아인 1688명)으로 한 다기관연구에서는 민감도를 고정 시 인종 및 전립선암 유병율에 따라 다른 기준치 (유럽인 >40, 아시아인 >30)를 보여서 아시아인에게는 유럽인보다 더 낮은 PHI 기준치를 적용할 것을 제시하였고, 제시된 기준치 적용 시 Gleason score 7이상의 고등급 전립선암을 약 10%정도 놓치면서 유럽인에서는 불필요한 생검을 40%, 아시아인에서는 56% 줄여주었다 [15], [표 1]. 한국인을 대상으로 한 연구 (n=246명)에서도 PHI 검사가 전립선암 및 임상적으로 의미 있는 암을 예측 시 다른 검사법보다 우수한 성능을 보였는데 [16], [표 2], PHI 기준치 23을 적용 시 고등급 전립선암은 하나도 놓치지 않으면서 약 21%의 불필요한 생검을 줄이는 결과를 보고하였다. 기준치를 낮추면 고등급 전립선암을 놓치지 않겠지만 불필요한 생검을 줄이는 효과가 줄어들고 기준치를 높이면 일부 고등급 전립선암을 놓칠 가능성이 있지만, 불필요한 생검을 크게 줄이는 효과를 볼 수 있다. 많은 한국인을 대상으로 한 연구를 통해 고등급 전립선암을 놓치지 않으면서 불필요한 생검을 줄일 수 있고 최대 경제적 효과를 볼 수 있는 최적의 PHI 기준치에 대한 설정이 필요하며, 여러 병원에서 누적된 결과를 토대로 한국형 기준치가 설정될 것이다.
표 1. Biopsies and Gleason 6 PC diagnoses that could be avoided at different PHI cutoffs (for Gleason 7 PC) in European and Asian cohorts
SV = sensitivity ; SP = specificity ; Bx = biopsy ; Dx = diagnosis.
aBiopsies saved if all men with a PHI score below cutoff are not biopsied (%) of all biopsies, n = 503 for the European and n = 1149 for the Asian cohort).
bExpressed as a percentage of all Gleason 7 cancers (n = 115 for the European and n =66 for the Asian cohort).
cExpressed as a percentage of all Gleason 6 cancers (n = 147 for the European and n = 85 for the Asian cohort).
표 2. Logistic regression analyses predicting Gleason score 7 in cancer patients
aBase model includes age, tPSA, and %fPSA.