1. Introduction
2. Functional brain imaging modalities
3. Brain-bladder control network: Normal volunteers
3.1. PAG (periaqueductal gray)
3.2. PMC (pontine micturition center)
3.3. L-region
3.4. PFC (Prefrontal cortex)
3.5. ACC (Anterior cingulate cortex)
3.6. Insula
3.7. Thalamus
3.8. Hypothalamus
3.9. Amygdala
3.10. Basal ganglia
4. Ageing brain and voiding dysfunction
5. Conclusion
1. Introduction
지금까지 배뇨 증상과 요실금에 대한 주된 접근 방식은 증상과 요역동학 연구 결과의 비교였다. 이러한 방광에 초점을 맞춘 접근법은 치료에 유용하지만, 요역동학 검사에서 관찰된 소견이 하부 요로 증상을 완전히 반영하지 못하는 경우도 있다. 원인이 뚜렷하지 않은 절박뇨, 빈뇨, 야뇨증, 요실금 등의 증상은 나이가 들면서 증가하는 경향이 있다. 반면, 눈에 띄는 요역동학적 이상 소견이 동반되더라도 많은 노인들은 요자제를 유지하거나 증상이 없는 상태를 유지할 수 있다. 젊은 성인과 달리 노년층에서의 요실금 원인은 다원적이며, 비뇨생식기 증상이 전신 건강 상태에 다양한 위험 요인을 유발하고 촉진하는 인자로 작용할 수 있다.
신경계는 하부요로 기능을 정상적으로 유지하는 데 중요한 역할을 하며, 방광벽의 긴장으로 인해 발생하는 구심성 정보에 반응하여 뇌의 통제를 받는다. 방광 채우기와 비우기를 자율적으로 제어하는 것 외에도 실시간으로 이루어지는 뇌의 제어는 중요하며, 노화에 따른 하부요로의 기능적 변화에 뇌-방광 상호작용의 연관성도 영향을 미칠 것으로 고려되어야 한다.
2. Functional brain imaging modalities
그동안 뇌의 배뇨 조절 역할을 연구하기 위해 다양한 기능적 뇌 영상 기법이 사용되었다. 영상 기법의 기본 개념은 특정 영역의 뉴런 활동 증가가 국지적 뇌 혈류 증가를 유발한다는 것이다. Single- photon emission computed tomography (SPECT)는 감마선을 이용한 핵의학 단층촬영 기술로, 3차원 뇌 정보를 제공할 수 있다. Positron emission tomography (PET) 역시 핵의학 영상 기법으로, 뇌의 활성화된 부위를 확인할 뿐만 아니라 활동 정도를 측정하는 기술이다. PET의 공간 해상도는 SPECT보다 두 배 높으며 시간 해상도도 우수하다. 초기 기능적 뇌 영상 감사는 대부분 PET를 통해 이루어졌다. fMRI (functional MRI)는 산소화 및 탈산소화 헤모글로빈의 상자성(paramagnetic) 특성을 정량화하며, 이는 신경 활동과 관련된 혈류 변화와 상관관계가 있다. PET나 SPECT와 달리 fMRI는 방사선 노출을 수반하지 않지만, 신호 대 잡음비가 높아 반복 촬영이 필요하다.
방광의 신경 조절을 확인하기 위해 기능적 뇌 영상을 사용한 초기 연구는 1996년 Fukuyama 등에 의해 시행되었다. 그들은 건강한 남성 지원자에서 배뇨 중 활성화되는 뇌 영역을 확인하였는데, 이 부위는 상부 뇌교(pons), 왼쪽 감각 운동 피질(sensorimotor cortex), 오른쪽 전두엽 피질(frontal cortex) 및 양측 보조 운동 영역(supplementary motor area, SMA)이었다.
3. Brain-bladder control network: Normal volunteers
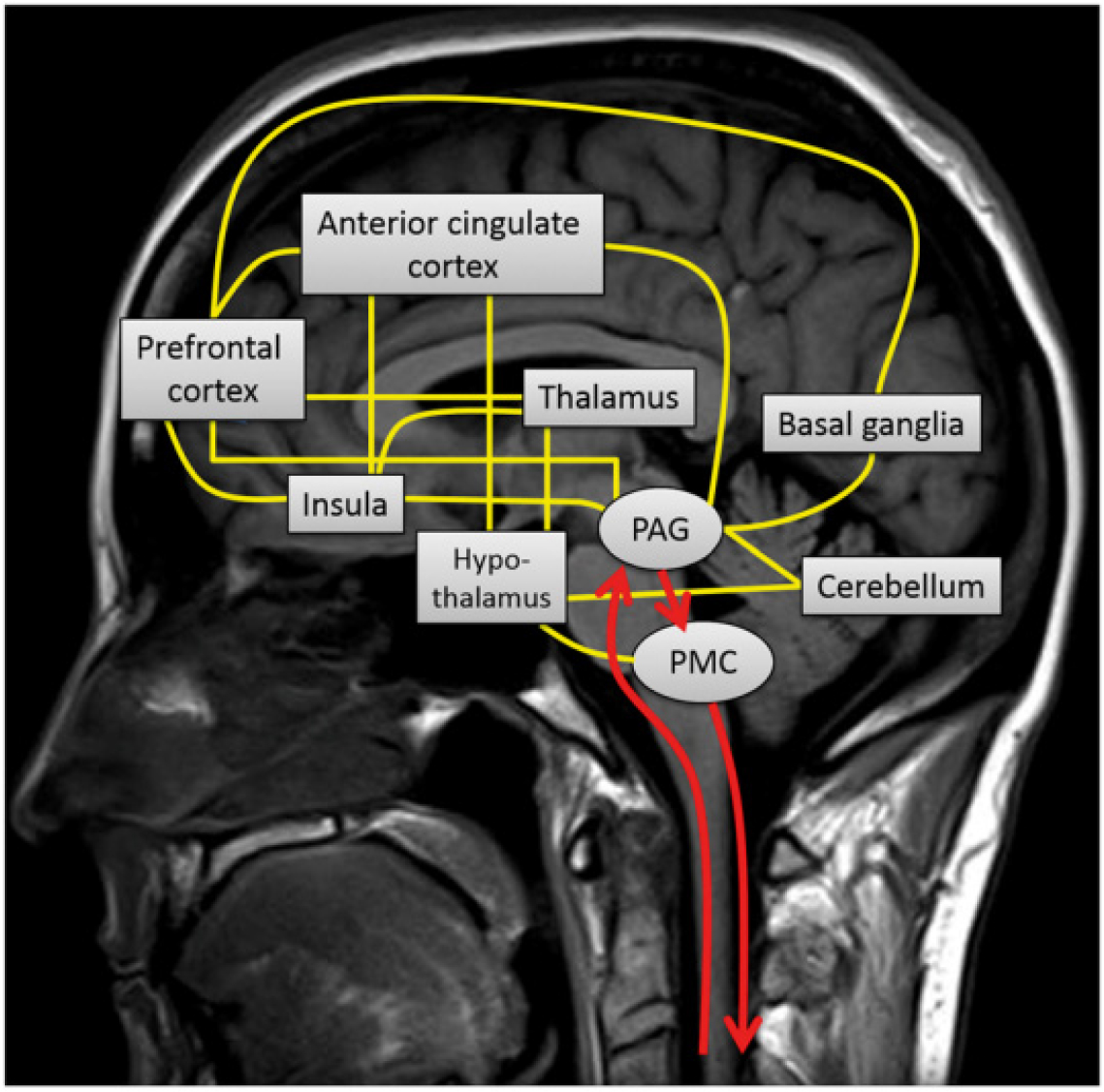
배뇨는 척추-구척수 반사(Spino-bulbospinal reflex)에 의해 조절된다. 저장 단계 동안 방광과 요도에서 발생하는 구심성 신호는 척수를 통해 중뇌(midbrain)의 periaqueductal gray (PAG) 시냅스로 올라가며, PAG는 뇌교(pons)로 원심성 억제 신호를 전달한다. 특정 임계값을 초과하면 반사가 시작되고 신호는 pontine micturition center (PMC)로 전송된다. PMC의 흥분은 하행 운동 원심성 뉴런(descending motor efferent neuron)을 활성화하여 오누프 핵(Onuf nucleus)을 통해 괄약근과 골반 횡경막(pelvic diaphragm)의 이완을 유도하고 흥분성 부교감 신경 경로(excitatory parasympathetic pathway)를 통해 배뇨근의 수축을 유도한다. 이러한 기본 개념은 기능적 뇌 영상 시대 이전에 제안된 것들이다. 그러나 뇌의 상위 영역에서 배뇨를 제어하는 회로는 여전히 불분명하다. 지금까지 확인된 배뇨와 관련된 피질 영역은 다음과 같다 [그림 1].
3.1. PAG (periaqueductal gray)
PAG는 방광 조절에서 중심 역할을 한다. 기능적 뇌 영상 연구에서 방광이 채워지면서 방광의 구심성 활동이 증가할 때 PAG의 활동이 증가하는 것을 확인했다. PAG는 또한 정서적 행동의 신체, 자율 및 감각 구성 요소를 통합하고 스트레스에 대한 반응을 조절한다. PAG는 시상하부(hypothalamus) 및 ACC (anterior cingulate cortex)와 같은 변연 전뇌(limbic forebrain) 내의 영역으로부터 직접 투영을 받는 것으로 추정된다. PAG로의 신경 입력은 사회적 상황에 따른 배뇨 자제 유지를 위한 전뇌에서의 신호 전달 가설의 기반이 될 수 있을 것으로 보이고, 이러한 발견은 PAG가 배뇨와 저장 기능 모두에 관여함을 시사한다.
3.2. PMC (pontine micturition center)
이전까지 “배링턴 핵(Barrington’s nucleus)” 또는 “M-영역”으로 알려진 PMC는 등외측 교뇌피개(dorsolateral pontine tegmentum)의 작은 영역에 위치하며 천골 척수(sacral spinal cord)와 직접 연결된다. 이 영역의 활성화는 가로무늬 요도 괄약근(striated urethral sphincter)의 이완과 방광 배뇨근의 수축을 시작하는 데 영향을 미친다. 인간을 대상으로 한 기능적 뇌 영상 실험에서 자발적 배뇨가 시작될 때 등쪽 뇌교 영역이 활성화된다는 사실이 확인되었다.
3.3. L-region
요도 괄약근 운동 뉴런을 포함하는 오누프 핵(Onuf nucleus)에 직접 신호를 보내는 곳이다. 이 영역의 병변은 배뇨근과다활동(detrusor overactivity, DO)과 요실금을 유발하므로, 요 자제력을 유지하는 데 중요한 역할을 한다. L-영역의 기능에 대해서는 아직까지 명확한 결론이 나지 않았다.
3.4. PFC (Prefrontal cortex)
배뇨 조절에서 전두엽의 역할은 약 50년 전 Andrew와 Nathan에 의해 처음 보고되었다. 배뇨는 의사 결정과 관련된 복잡한 과정으로 전뇌에서 처리되는 높은 수준의 기능이다. 기능적 뇌 영상 연구는 방광 조절을 위한 PFC의 중요성에 대한 이해를 크게 향상시켰다. PFC는 복잡한 인지 행동과 적절한 사회적 행동을 제어한다. 그러나 PFC가 배뇨 과정을 억제하거나 자극하는지, 아니면 실제로 두 가지 기능을 모두 가지고 있는지는 아직 확실하지 않다. PFC와 배뇨 회로 사이의 연결 역시 불확실하다. 그러나 PFC는 ACC (anterior cingulate cortex)와 여러 연결을 갖고 있으며, 두 영역 모두 시상하부, PAG 및 자율 제어와 관련된 기타 영역과 직/간접적으로 연결되어 있다. PFC는 독립된 의사 결정 센터가 아니라 결정을 계산하기 위해 감각적 증거를 처리하고 이 증거를 행동으로 변환하는 네트워크의 일부일 가능성이 높다.
3.5. ACC (Anterior cingulate cortex)
이전 연구에서 ACC는 골반저 수축을 포함하여 방광 충만감 및 배뇨 조절에 관여하는 것으로 나타났다. ACC는 감각뿐만 아니라 배뇨의 정서적 동기 부여에도 중요한 역할을 한다.
3.6. Insula
정상적인 방광 기능을 가진 피험자에서 방광 충만이 증가함에 따라 뇌섬(insula)이 강하게 반응한다. Insula는 통각을 입력 처리하는 곳으로, 위장관의 내장 감각 매핑과 관련된 paralimbic system의 일부이다. 뇌섬은 변연계와 자율신경 반응의 통합에 관여하는 것으로 추정된다.
3.7. Thalamus
시상은 후각을 제외한 모든 감각 경로를 연결하는 데 중요한 역할을 한다. 받아들인 감각 정보의 추가 처리를 위해 대뇌 피질로 전달하는 중계소이기도 하다. 최근 기능적 뇌 영상 연구에서는 방광이 채워지면 시상이 활성화되는 것으로 보고되었다.
3.8. Hypothalamus
시상하부는 주요 내장 조절 센터이며 저장 또는 배뇨 중 구심성 신호를 PMC에 직접 보내는 영역 중 하나이다. 시상하부까지 확장된 뇌하수체 종양 환자에서 과민성 방광(overactive bladder, OAB) 또는 요폐가 나타났다. 최근 연구에서 이 영역이 억제 기능을 갖고 있는 것으로 생각되며, 이 영역의 비활성화는 배뇨가 “안전”하다는 신호를 제공하는 것으로 보인다.
3.9. Amygdala
편도체는 감정, 특히 공포 감정에서 중요한 역할을 한다. 또한 이 영역은 감정적인 사건에 대한 무의식적 반응과 의식적 반응 사이를 중재한다. 절박뇨는 이러한 감정과 연관될 수 있으나, 기능적 뇌 영상 연구에서는 편도체의 활동이 관찰되지 않았다. 반면에 다른 연구에서는 OAB 환자에서 편도체가 비활성화되는 경향이 있다고 보고했다.
3.10. Basal ganglia
기저핵은 시상의 양쪽, 변연계 외부 및 위쪽에 위치하며 대뇌 피질, 시상 및 기타 뇌 영역과 연결된 핵 그룹이다. 파킨슨병은 기저핵 중 주로 선조체(striatum)의 도파민 고갈에 의해 유발되는 진행성 신경퇴행성 질환으로, 운동 증상뿐만 아니라 주로 DO에 의해 유발되는 절박뇨, 빈도 및 요실금과 같은 비운동 증상도 유발한다.
4. Ageing brain and voiding dysfunction
노화가 진행되면서 하부 요로에 대한 중추 신경 제어에도 영향을 준다는 증거가 점점 늘어나고 있다. 노화가 진행된 경우, 오른쪽 뇌섬(insula)에서 방광 충만에 대한 반응이 감소하여 방광이 완전히 찰 때까지 감각을 인지하지 못하는 경우가 있으며, 이는 절박뇨를 유발할 수 있다. 노인 절박 요실금 환자에서는 전대상회(anterior cingulate gyrus)의 활성화가 정상보다 강하게 나타났다. 소혈관 질환에서 관찰되는 백질 고강도(white matter hyperintensity, WMH)는 노화된 뇌에서 자주 관찰되며, WMH가 배뇨 조절과 관련된 뇌 영역에 존재하는 경우 배뇨 장애와 관련될 수 있다. 오른쪽 아래 전두엽 영역과 대상회(cingulate gyrus)에 위치한 WMH는 요실금과 관련되며, 오른쪽 전시상 방사선(thalamic radiation)에 WMH가 존재하면 배뇨근 과활동과 관련된다.
심리사회적 요인도 배뇨 기능에 영향을 미칠 수 있다. 사회적으로 박탈당한 어린 성체 생쥐에서는 배뇨근 과활동과 유사한 비배뇨성 방광 수축이 발생하며, 단기간에는 배뇨 간격이 감소했지만, 장기간 노출될 경우 방광 용량과 배뇨 간격이 모두 증가하여 결과적으로 방광벽이 재형성된다. 노화는 불안이나 우울증의 증가, 사회적 참여의 감소, 인지 장애 등의 행동 변화와 관련이 있으며, 이러한 요인이 연령 관련 배뇨 기능 장애에 기여하는 정도에 대해서는 추가 조사가 필요하다.
5. Conclusion
수많은 기능적 뇌 영상 연구, 신경해부 연구 및 동물 연구가 배뇨와 관련된 뇌의 영역과 그 연결을 보여주었다. 그러나 뇌-방광 제어 네트워크에 대한 이해는 아직 부족한 것도 사실이다. 뇌 기능에 대한 현재의 통찰력을 향상시키고 뇌의 배뇨 조절 실패로 이어지는 요인을 정의하기 위해서는 더 많은 연구가 필요하다. 현재까지의 증거에 따르면 노화에 따른 하부 요로 증상, 특히 과민성 방광 및 요실금의 유병률 증가는 말단 기관의 변화보다는 뇌 안에서의 변화와 더 관련이 있을 가능성이 높다. 노화된 하부 요로에 대한 항상성 조절을 담당하는 특정 뇌 프로세스에 대한 이해는 노화에 따른 배뇨 증상에 대한 치료적 접근에 큰 도움이 될 것이다.