1. 서론
2. 본론
2.1. PSA의 발견의 역사
2.2. PSA 유전자 구조와 Tissue Kallikrein Gene Family
2.3. 안드로겐에 의한 PSA 발현의 조절
2.4. 안드로겐-비의존성 전립선암에서의 PSA 발현
2.5. PSA의 Biosynthesis
2.6. 말초 혈액에서의 PSA
3. 결론
1. 서론
전립선특이항원(Prostate-Specific Antigen, PSA)은 안드로겐에 의해 조절되는 세린 프로테아제(serine protease)로, 조직 칼리크레인(tissue kallikrein) 계열의 단백질에 속한다. PSA는 주로 전립선의 관상피세포(ductal epithelium)와 선상피세포(acinar epithelium)에서 생성되어 정액 내에서 세메노겔린 I 및 II(semenogelin I & II)를 절단하는 기능을 수행한다. 그러나 PSA가 종양학에서 중요한 이유는 전립선암(prostate cancer, PCa)을 진단하고 치료 반응을 평가하는 생체표지자(biomarker)로서의 역할 때문이다. PSA 검진의 효용성과 적절한 사용에 대해서는 여전히 논란의 여지가 있지만, 초기 치료의 성공은 종양이 전립선 외부로 확산되기 전 상태인 국소 병기에 종양을 진단하는 것에 달려 있다. 아쉽게도, 혈청 PSA (total PSA)는 초기 단계 종양을 정확히 감지할 수 있을 정도의 민감도와 특이도를 제공하지 못한다. 하지만 PSA에 대한 이해는 전립선암 진단의 정확성을 향상시킬 가능성이 있으며, 전립선암의 치료 후 추적, 예후 판단 등에 있어 중요한 인자로 활용되고 있다. 본 리뷰에서는 PSA의 기본적인 생물학적 특성을 개괄하고, 특히 전립선암 진단 및 병인과 관련된 PSA의 특성을 정리해보고자 한다.
2. 본론
2.1. PSA의 발견의 역사
PSA의 발견은 여러 연구자들의 복합적인 연구의 결과로, 초기에 전립선 조직과 정액에서 독립적으로 발견되어 각각 다른 명칭을 사용하여 혼란을 초래하기도 하였다. 1960년대 후반에서 1970년대 초반, 면역학의 발전으로 조직 및 체액에서 항원을 찾는 연구가 활발하게 시행되었다. 1970년 Richard J. Ablin은 “Prostate specific antigen”이라는 용어를 처음 사용하여 전립선에서 특이적인 항원을 발견했으며, 이 항원이 전립선에 특이적임을 입증하려는 연구를 진행하였다. 일본의 Mitsuwo Hara 교수는 성범죄 사건의 법의학적 증거로 활용할 수 있는 항원을 찾는 연구의 일환으로 정액 내의 특정 단백질인 “γ-seminoprotein”을 발견했는데, 이 단백질은 이후 PSA와 유사한 구조를 지니고 있음이 밝혀졌다. 그러나 초기 연구가 일본어로 발표되어 국제 과학계에 널리 알려지지는 못했다. 1973년, Tien Shun Li와 Carl G. Beling은 “protein E1 antigen”을 정액에서 분리했으나, 이 단백질이 PSA와 유사함에도 불구하고 전립선에서 기원된 것이라고 규명하지 못했다. 하지만 George Sensabaugh는 1978년 E1 단백질을 다시 연구하여 정액의 주요 항원 p30과 PSA가 유사하다는 사실을 밝혔고, 전립선이 그 기원임을 확인하였다. 1979년, Ming C. Wang은 처음으로 전립선 조직에서 PSA를 정제하여 명명하였으며, Lawrence C. Papsidero는 혈액 내 PSA를 처음으로 측정하였고, 이는 전립선에서 정제한 것과 동일하다고 보고하였다. 이후 1980년대에 Thomas A. Stamey는 PSA 수치가 전립선암 진단에 유용하다는 것을 임상적으로 입증하며 PSA가 전립선암의 종양 표지자로 활용되기 시작하였다. PSA의 발견과 임상적 활용은 여러 과학자들의 노력의 결과물이며, 현재까지도 전립선암 진단의 핵심 도구로 사용되고 있다.
2.2. PSA 유전자 구조와 Tissue Kallikrein Gene Family
PSA는 KLK3 유전자에 의해 암호화되는 단백질로, 조직 칼리크레인(tissue kallikrein) 패밀리에 속하며, 19번 염색체의 19q13.4 영역에 위치한다. 칼리크레인은 본래 특정 고분자량 단백질을 분해하여 생체활성을 가지는 키닌(kinin)이라는 펩타이드를 방출하는 세린 프로테아제(serine protease)로, 각종 생리적 과정에서 중요한 역할을 수행하는 것으로 알려져 있다. 현재 칼리크레인은 조직 칼리크레인(tissue kallikrein)과 혈장 칼리크레인(plasma kallikrein)으로 분류된다. 최근까지 hK1, hK2 (glandular kallikrein), hK3 (PSA) 세 가지 인간 조직 칼리크레인이 밝혀졌으나, cDNA 클로닝과 인간 유전체 서열 분석을 통해 총 15개의 조직 칼리크레인 유전자가 19번 염색체 19q13.3-q13.4에 존재하는 것이 확인되었다. 이들 유전자는 5개의 유사한 크기의 엑손(exon)으로 구성되며, 40%에서 80%의 서열 유사성을 가진다. hK1을 암호화하는 KLK1 유전자는 가장 가까운 중심체에 위치하며, KLK15, KLK3(PSA를 암호화), 그리고 KLK2가 그 뒤를 잇는다.
KLK3 유전자는 전립선에서 특이적으로 발현되며, 그 산물인 PSA는 주로 정액에서 고농도로 존재한다. PSA는 분비단백질로, 아미노말단의 신호 펩타이드(signal peptide)와 N-말단의 소형 전구 펩타이드(propeptide)를 포함한 비활성 형태(zymogen)로 합성된 후 전립선 내에서 활성화되어 역할을 수행한다. 이 과정에서 PSA는 Zn2+와 같은 금속 이온에 의해 활성이 조절되며, 이는 정액에서 액화 과정에 중요한 역할을 한다. PSA는 정액 내 단백질인 SEMG1 및 SEMG2와 결합하여 액화 과정에서 이들의 분해를 촉진함으로써 정자의 운동성을 증가시키는 데 기여한다. 칼리크레인 유전자 군은 진화적으로 중복과 변이를 거치면서 확장되었으며, 다양한 생리적 기능을 가진 여러 분자들을 포함하게 되었다. 특히, 이 군의 유전자들은 남성 생식, 피부의 항상성 유지, 신경 발달 등의 다양한 생리적 기능과 밀접한 관련이 있는 것으로 알려져 있다.
2.3. 안드로겐에 의한 PSA 발현의 조절
PSA 유전자의 전사는 안드로겐 수용체(AR, Androgen Receptor)에 의해 조절을 받는다. 안드로겐 수용체는 특정 DNA 서열인 안드로겐 반응 요소(ARE, Androgen-Responsive Elements)에 결합하여 전사를 활성화하는 스테로이드 호르몬 수용체로 작용한다. PSA 유전자 전사 시작점으로부터 -156에서 -170 위치에 안드로겐 수용체(AR)가 강력하게 결합하는 ARE가 위치하며, 이는 PSA 발현에 중요한 역할을 한다. 쉽게 설명하자면, DNA 서열에서 안드로겐 수용체가 결합할 때 가장 잘 맞는 “주된 자리” 혹은 “대표적인 결합 부위”라고 할 수 있다. 이 위치에 AR이 결합하면 PSA 유전자와 같은 특정 유전자의 발현이 효과적으로 활성화된다.
추가적으로, 높은 수준의 안드로겐 자극 하에서 PSA 발현을 매개하는 주요 영역은 전사 시작 지점으로부터 약 4.2 kb 상류에 위치한 PSA 원거리 증강체(distal enhancer)에서 발견된다. 이 영역에는 강력한 ARE (ARE III)가 포함되어 있으며, 이외의 여타 ARE가 존재하여 여러 AR이 이 영역에 결합하여 강력한 안드로겐 의존적 활성화를 일으킨다 [그림 1].
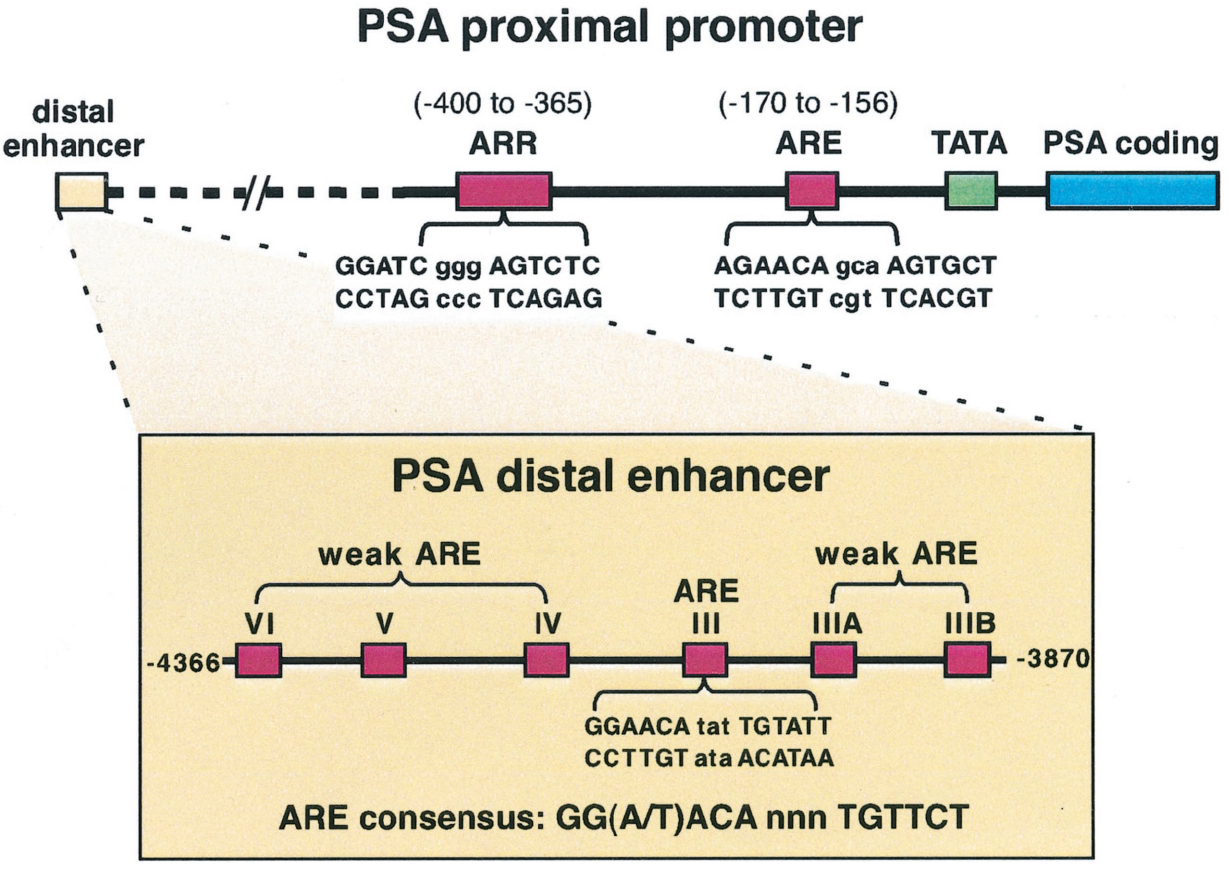
그림 1.
전립선특이항원(Prostate-Specific Antigen, PSA) 유전자 발현을 조절하는 주요 영역
PSA 근접 프로모터(Proximal Promoter): PSA 유전자의 코드 영역 바로 상류에 위치한 근접 프로모터는 안드로겐 반응 요소(ARE, Androgen-Responsive Element)와 안드로겐 반응 영역(ARR, Androgen-Responsive Region)을 포함하고 있다. 이러한 요소들은 안드로겐 수용체(AR)가 결합하여 PSA 유전자의 발현을 유도하는 데 중요한 역할을 한다. 원거리 증강체(Distal Enhancer): 높은 수준의 PSA 발현을 매개하는 주요 영역은 원거리 증강체로, 전사 시작점으로부터 약 4.2 kb 상류에 위치해 있다. 이 영역에는 중심에 다양한 ARE가 포함되어 있어 AR이 협력적으로 결합하면서 강력한 안드로겐 의존적 활성을 촉진한다.
PSA는 전립선암(Prostate Cancer, PCa)에서도 일관되게 발현되지만, 정상 전립선 상피에 비해 세포 당 발현 수준은 낮은 편이다. 그러나 여기서 말하는 “세포 당 발현 수준”은 개별 전립선암 세포가 만드는 PSA의 양이 정상 전립선 세포보다 낮다는 것을 의미한다. 전립선암에서 혈중 PSA 수치가 높은 이유는 암세포가 정상 세포보다 조직 구조를 더 쉽게 파괴하며, 그로 인해 PSA가 혈액으로 더 쉽게 유출되기 때문으로 알려져 있다. 또한, 전립선암 세포가 더 많은 수로 증식하기 때문에, 전체적으로 PSA 수치가 높게 나타나지만, 개별 세포의 PSA 생산량은 정상 세포보다 낮을 수 있다. 따라서 전립선암에서 PSA 수치가 높아지는 이유는 암세포의 숫자가 많아지거나 조직 구조가 파괴되어 PSA가 혈액으로 잘 유출되기 때문이지, 개별 암세포가 더 많은 PSA를 생성하는 것은 아닐 수 있다. 그러므로 특정 PSA 수치가 전립선암 진단에 절대적이지 못하고 cut-off value 이하에서도 전립선암이 진단되는 이유라고 할 수 있다.
안드로겐 차단 요법(androgen deprivation therapy, ADT)에 반응하여 PSA 수준이 감소하는 것은 종양 세포의 사멸에 기인하는 부분도 있지만, 생존하는 종양 세포에서 AR에 의해 유도되는 PSA 생산이 감소한 결과이기도 하다. 이러한 이유로, ADT는 일부 경우 PSA 생산에 대한 효과가 종양 생존에 대한 효과보다 클 수 있다. 특히, 완전 안드로겐 차단 요법은 castration 단독 치료에 비해 PSA 수준의 더 빠른 감소와 낮은 최저점을 유도하지만, 이는 생존율 향상으로 이어지지는 않는 이유라고 할 수 있다. 따라서 동일한 치료를 받는 환자들 사이에서 PSA 감소의 속도와 크기가 임상적 반응을 예측하는 지표가 될 수 있으나, 서로 다른 치료를 비교할 때에는 주의가 필요하다.
2.4. 안드로겐-비의존성 전립선암에서의 PSA 발현
PSA는 대부분의 안드로겐-비의존성 전립선암(androgen-independent prostate cancer, AIPC)에서도 발현된다. 전립선암이 안드로겐 억제 요법(hormone deprivation therapy)을 통해 호르몬 의존성을 상실한 후에도, PSA는 여전히 발현되는 경향을 보인다. 이러한 발현은 안드로겐 수용체(AR)의 지속적인 전사 활성에 의해 조절되는 것으로 보인다. 안드로겐 억제 요법은 암세포 내의 AR 및 AR과 상호작용하는 전사 보조 단백질에 다양한 유전적 변화를 유발하며, 이러한 변화는 낮은 안드로겐 농도에서도 AR이 활성화될 수 있도록 한다.
이러한 안드로겐-비의존성 상태에서의 PSA 발현은 AR 길항제에 대해서도 저항성을 보이는 경향이 있다. 이는 안드로겐-의존성 전립선암과 달리, PSA 발현과 암세포 증식 사이의 연관성이 더 약하다는 것을 시사한다. 즉, 안드로겐 비의존성 상태에서는 PSA 발현이 항상 암의 진행 정도를 정확히 반영하지 않을 수 있다. 그러나 여전히 PSA 수치가 계속 측정되는 것은 AIPC의 치료 경과를 파악하는 데에 어느 정도 참고가 된다. 안드로겐 차단 후 PSA 수치가 갑자기 크게 올라간다면, 이는 암이 더 악성으로 변하거나 빠르게 진행될 가능성을 시사하는 중요한 신호로 해석될 수 있다. 이런 초기의 PSA 급상승은 AIPC의 빠른 진행을 예측하는 데 중요한 단서가 될 수 있다. AIPC에서의 PSA 발현은 단순히 진단 지표로서의 역할을 넘어, AR의 비전형적 활성화와 암세포의 적응적 변화를 반영하는 생물학적 지표로도 이해될 수 있다. 이러한 특성은 향후 PSA를 활용한 AIPC의 진단 및 치료 전략 개발에 중요한 기초 자료가 될 것이다.
2.5. PSA의 Biosynthesis
PSA는 세포 내에서 먼저 “preproPSA”라는 형태로 합성된다. 이 “preproPSA”는 17개의 아미노산으로 구성된 리더 서열(leader sequence)을 가지는데, 단백질이 세포 외부로 이동하는 과정에서 이 서열은 제거되며 244개의 아미노산으로 구성된 불활성 전구체인 “proPSA”를 생성한다. “proPSA”는 다시 한번 효소에 의해 N-말단의 7개의 아미노산이 절단되면서 활성 형태의 PSA가 된다 [그림 2]. 이 절단은 주로 전립선 분비 상피에서 주로 발현되는 hK2 (human glandular kallikrein 2)라는 효소에 의해 이루어진다. hK2는 트립신(trypsin)과 유사한 활성을 가지며, “proPSA”에서 아르기닌(arginine)과 이소류신(isoleucine) 사이를 절단하여 활성 형태의 PSA를 생성한다. 정액 내 PSA의 약 30%는 활성 상태의 단백질분해효소 활성을 가지며, 약 5%는 protein C inhibitor와 결합된 형태로 존재한다. 추가적인 형태로는 내부 아미노산 간의 절단으로 불활성화된 PSA 형태도 있으며, 이 형태의 PSA는 전립선 이행대(transition zone)에서 발견되고 전립선비대증(benign prostatic hyperplasia) 환자에서 흔히 발견된다. 이러한 형태는 BPSA로 불리기도 하며, BPH와 관련된 PSA의 일종으로 여겨진다. 한편 전립선암 조직에서는 특정한 절단이 이루어진 “proPSA”의 변형된 형태도 발견된다. 이러한 변형된 형태는 Leucine과 Serine 사이에서 절단되어 두 개의 추가 아미노산을 가지는 [-2]pPSA와 같은 불활성 형태로, 이 형태는 안정적이며 추가적인 절단이 일어나지 않는다. 면역조직화학적 연구에서는 이 형태가 악성 전립선 샘에서 증가된 것으로 나타났으며, 전립선암 환자 혈중에도 다량으로 발견된다 [그림 3].
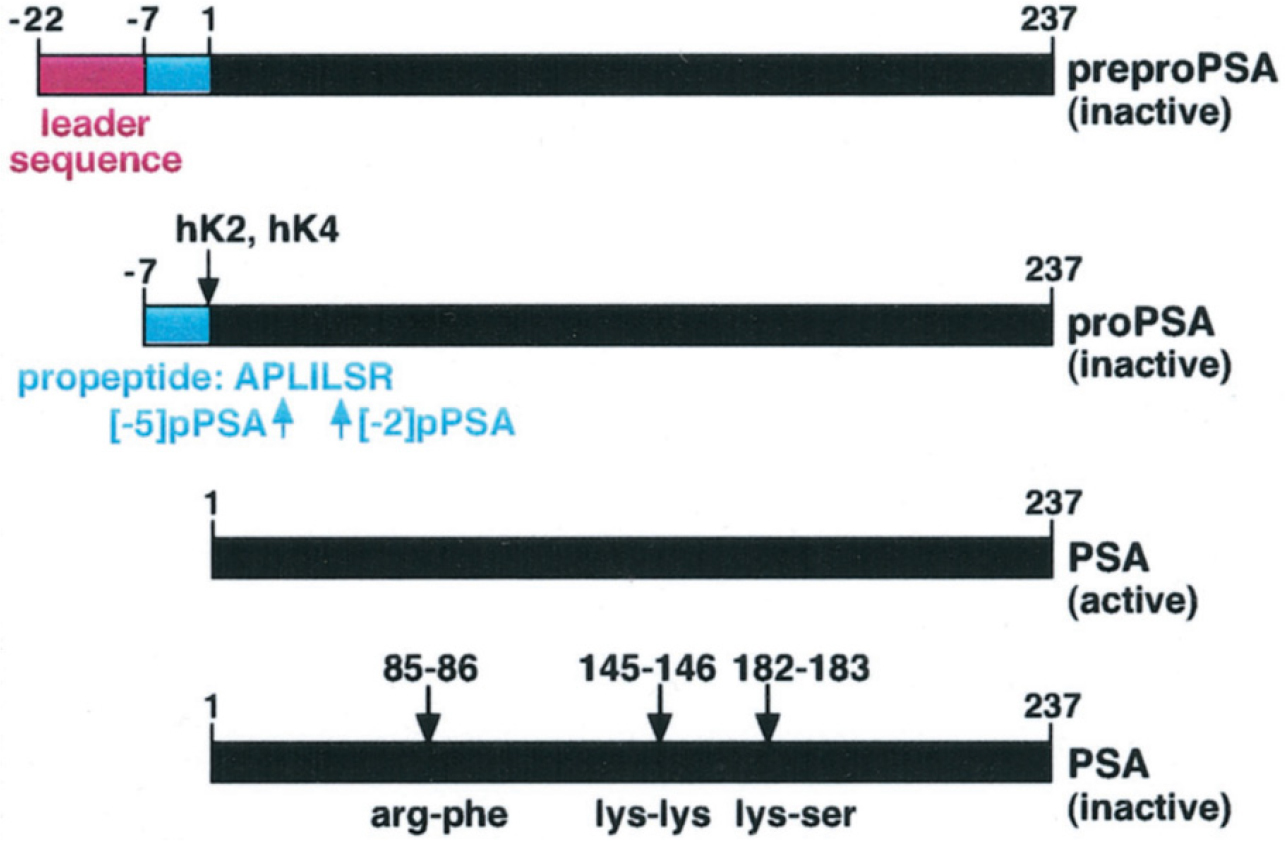
그림 2.
PSA 구조와 활성화 과정
PSA는 먼저 세포 내에서 “preproPSA” 형태로 합성된다. 이 형태는 17개의 아미노산으로 구성된 리더 서열을 가지고 있으며, 이 리더 서열은 제거되어 불활성 전구체인 “proPSA”로 전환된다. 불활성 형태의 proPSA는 전립선 분비 상피에서 주로 발현되는 hK2 (human glandular kallikrein 2)에 의해 N-말단의 7개의 아미노산이 절단되면서 활성화된 성숙형 PSA가 된다. proPSA는 또 다른 절단 과정을 통해 다양한 절단 형태로 변형될 수 있으며, 이러한 변형된 형태들(예: [-2]pPSA 및 [-5]pPSA)은 효소 활성화가 불가능한 상태로 존재한다. 이와 같은 절단된 proPSA 형태는 주로 전립선암 환자에게서 발견되며, 불활성 형태로서 자유 PSA (free PSA)로 순환하는 것으로 알려져있다. 활성 PSA (PSA active)는 전립선의 lumen 내에서 단백질 분해 효소로서 작용하며, 정액에서 세메노겔린(smenogelin)을 분해하여 정액을 액화시키는 주요 역할을 수행한다. 그러나 활성 PSA가 duct의 lumen 내에서 특정 아미노산 위치에서 절단되면 효소 활성을 잃게 되어 비활성 PSA (PSA inactive)로 전환된다. 이러한 절단은 주로 아미노산 서열의 85-86, 145-146, 또는 182-183 위치에서 발생하며, 절단 후 PSA는 본래의 구조를 잃고 효소로서의 기능을 상실하게 된다.
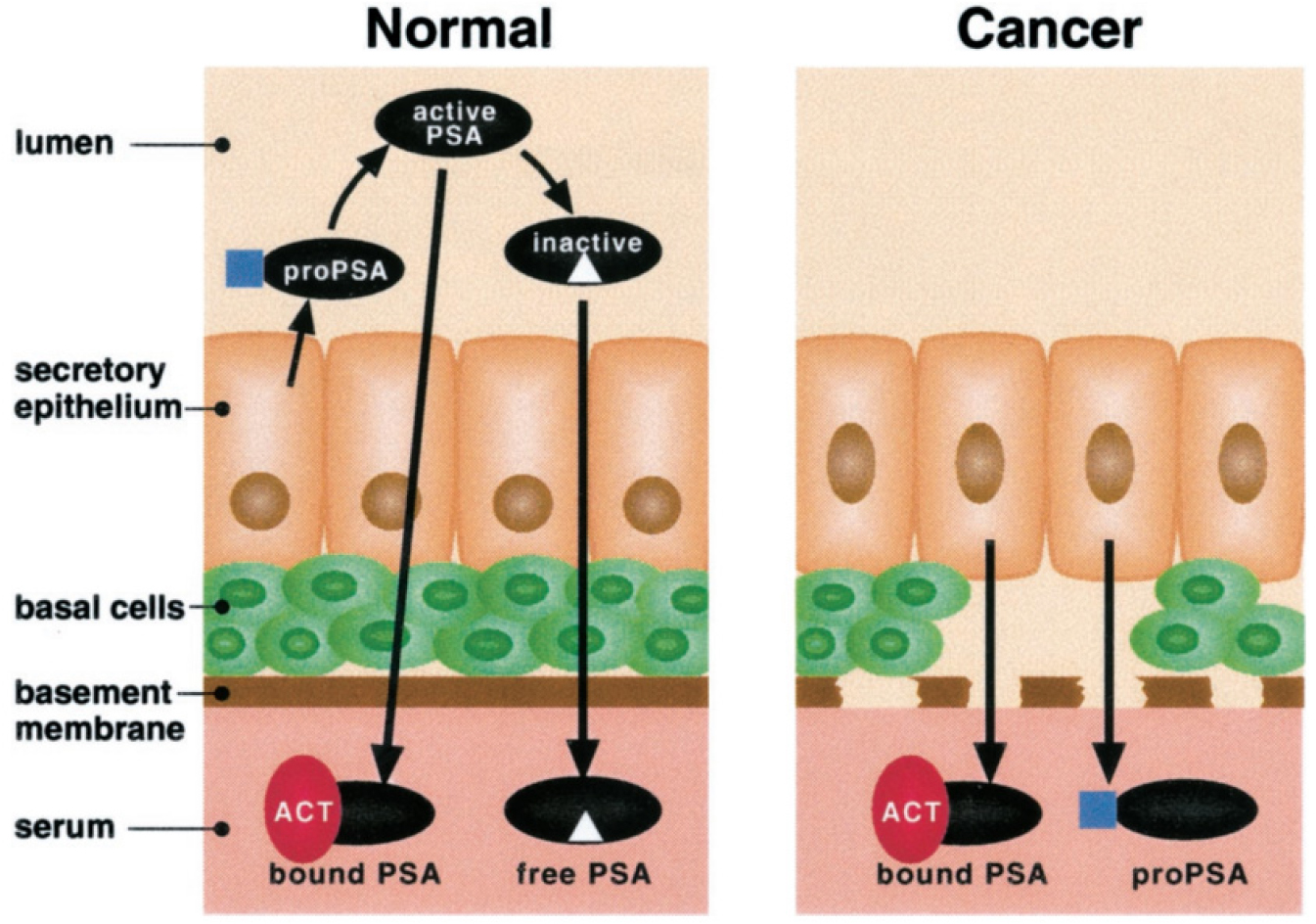
그림 3.
정상 전립선 상피와 전립선암에서의 PSA 생합성 모델
정상 전립선의 분비 상피세포는 주변을 둘러싼 기저세포층(basal cell layer)과 기저막(basement membrane)으로 보호된다. Secretory epithelium은 PSA의 전구체인 proPSA를 lumen으로 분비하며, lumen 내에서 hK2 (human glandular kallikrein 2)에 의해 N-말단의 전구 펩타이드가 절단되어 활성 PSA가 생성된다. 이렇게 활성화된 PSA의 일부는 혈액으로 확산되어 들어가지만, 대부분은 단백질분해 억제제(특히 alpha1-antichymotrypsin)와 결합하여 비활성화된다. 또한, 활성 PSA는 lumen 내에서 추가적인 단백질분해 과정을 거쳐 비활성 PSA로 변환되고, 이러한 비활성 PSA는 자free PSA 형태로 혈류에 존재하게 된다. 전립선암이 진행되면 기저세포층(basal cells)과 기저막(basement membrane)이 파괴되거나 손실된다. 이는 정상적인 lumen 구조의 손상으로 이어져, PSA가 비정상적으로 순환계로 접근할 수 있는 통로로 작용한다. 이로 인해 proPSA가 lumen에서 정상적으로 처리되지 못하고, 활성 PSA로 전환되는 과정이 감소하게 된다. 따라서, 혈중에 결합된 PSA (bound PSA)와 proPSA 형태의 PSA가 상대적으로 증가한다. 이러한 변화로 인해 전립선암 환자의 혈청에서 비활성화된 free PSA의 비율이 감소하고, proPSA와 같은 전구체 형태가 증가하게 된다.
2.6. 말초 혈액에서의 PSA
말초 혈액(peripheral blood)에 존재하는 PSA의 대부분(약 70%에서 90%)은 단백질 분해 억제제인 알파1-안티카이모트립신(alpha1-antichymotrypsin, ACT)과 결합하여 80~90kDa의 복합체 형태로 순환한다. 소량의 PSA는 알파2-매크로글로불린(alpha2-macroglobulin) 및 알파1-안티트립신(alpha1-antitrypsin)과도 결합하지만, 대부분의 PSA 검출 항체는 free PSA와 대부분의 복합체 결합 PSA (complexed PSA)를 인식한다. 다만, 알파2-매크로글로불린과 결합한 PSA는 완전히 단백질에 둘러싸여 있기 때문에 검출되지 않는다.PSA 중 효소 활성을 상실한 형태는 특정 아미노산 위치(85-86, 145-146, 182-183)에서 내부 절단이 일어나 복합체를 형성하지 못하고, 자유 PSA 형태로 순환하며 이는 총 PSA의 약 10%에서 30%를 차지한다. 정상적인 경우, 이러한 내부 절단은 주로 정액에서 발생하며 전립선암 조직에서는 감소하는 경향이 있다. 결과적으로, 전립선암 환자에서는 free PSA와 total PSA의 비율(free-to-total PSA ratio, PSA index)이 낮아지는 경향을 보이며, 이는 정상과 전립선암을 구별하는 데 도움을 줄 수 있다. 또한, 혈청에서는 proPSA와 다양한 절단 형태의 proPSA도 검출될 수 있다. 생검을 통해 전립선암으로 진단된 환자군(혈청 총 PSA 6~24 ng/mL)에서 자유 PSA 중 큰 비율(25%에서 95%)이 [-2]pPSA 형태를 차지하는 것으로 나타났다. 이와 같은 결과는 생검에서 전립선암이 확인되지 않은 환자에 비해 높은 수치를 보이며, 이는 PSA 검사 특이성을 높이는 prostate health index 등의 지표로 이용되고 있다. 이와 같은 말초 혈액 내 PSA의 다양한 형태와 결합 양상은 전립선암 진단과 예후 예측에서 중요한 정보를 제공한다.
혈청 내의 복합 PSA (complexed PSA)는 신장의 사구체를 통과하지 못하기 때문에 대부분은 간을 통해 제거된다. 혈청 PSA의 반감기는 2.2±0.8~3.2±0.1일 정도 보고된다. 혈청 내의 free PSA는 2~3시간 이내에 혈청에서 제거되는 것으로 알려져 있으며, 크기가 작아 신장을 통해 배설되거나 항단백질분해효소와 새로이 복합체를 형성한 후에 제거된다. 임상적으로는 근치적 전립선적출술 후 PSA의 측정 시기가 중요한데, 전립선을 절제한 후 혈청에서 PSA가 확인되지 않기까지 수술 후 수주가 소요된다. 일반적으로 성공적인 수술 후 6주 이내 PSA 수치는 측정 불가능한 수준으로 감소하는 것으로 알려져 있다.
3. 결론
PSA는 전립선암 진단과 치료 경과 모니터링에서 중요한 생체표지자로서 광범위하게 사용된다. PSA는 안드로겐에 의해 조절되는 세린 프로테아제(serine protease)로, 전립선암을 비롯한 전립선 질환의 진단 및 예후 평가에 필수적인 역할을 한다. 비록 PSA 수치가 전립선암의 민감도와 특이도를 완벽히 반영하지는 못하지만, PSA의 다양한 분획(free PSA, complexed PSA, proPSA 등)과 이들의 비율은 전립선암과 양성 질환을 구분하는 데 유용하게 이용되고 있다. PSA는 정상 전립선 상피세포뿐만 아니라 전립선암 세포에서도 발현되며, 전립선암 세포의 조직 구조 파괴와 혈중 유출 증가로 인해 PSA 농도가 상승하게 된다. 또한, PSA는 IGF 결합 단백질 분해와 같은 다양한 생리적 기능을 통해 종양의 성장과 전이에 기여할 가능성도 제기되고 있다. 향후 PSA의 기능적 특성과 다양한 분획의 임상적 의미를 더욱 구체적으로 이해하게 된다면, 전립선암 진단과 치료에서 PSA의 역할이 더욱 확대될 것으로 기대된다.



