1. 서론
임균(Neisseria gonorrhoeae)은 임질의 원인균으로 이는 가장 흔한 박테리아성 성매개감염병 중 하나이다. 임균에 의한 감염은 한동안 비교적 치료하기 쉬운 것으로 간주되었지만, 임질의 치료에 사용되는 모든 항생제들에 대한 내성 균주들이 출현하고 확산되면서 임균의 항균제 내성은 전 세계적으로 주요한 공중 보건 문제로 떠오르고 있다. 현재 임질의 치료로 병합 항균 요법(주로 ceftriaxone 250-500 mg × 1 + azithromycin 1-2 g × 1)이 많은 국가에서 권장, 사용되고 있는데, 이러한 병합 요법은 치료율이 높고 cephalosporin 내성 수준을 낮추는데 기여하여 다제내성 임균 균주의 확산을 억제하는 것으로 생각되어 왔다. 그러나 이 치료 지침은 전 세계적으로 검출되는 ceftriaxone, cefixime 및 azithromycin 내성 임균 균주의 수가 증가함에 따라 위협을 받고 있다. 따라서 이 "슈퍼버그"와의 전쟁에서 새로운 치료 옵션에 대한 개발이 필수적이게 되었다. 이 원고에서는 임균 내성의 최신 현황과 이에 맞추어 최근 개정된 임질 치료 지침, 그리고 다제내성 시대의 임질의 치료 전망에 대해 알아보고자 한다.
2. 본론
2.1. 임균의 항생제 내성 현황
2.1.1. 과거의 치료 실패: 단일 요법
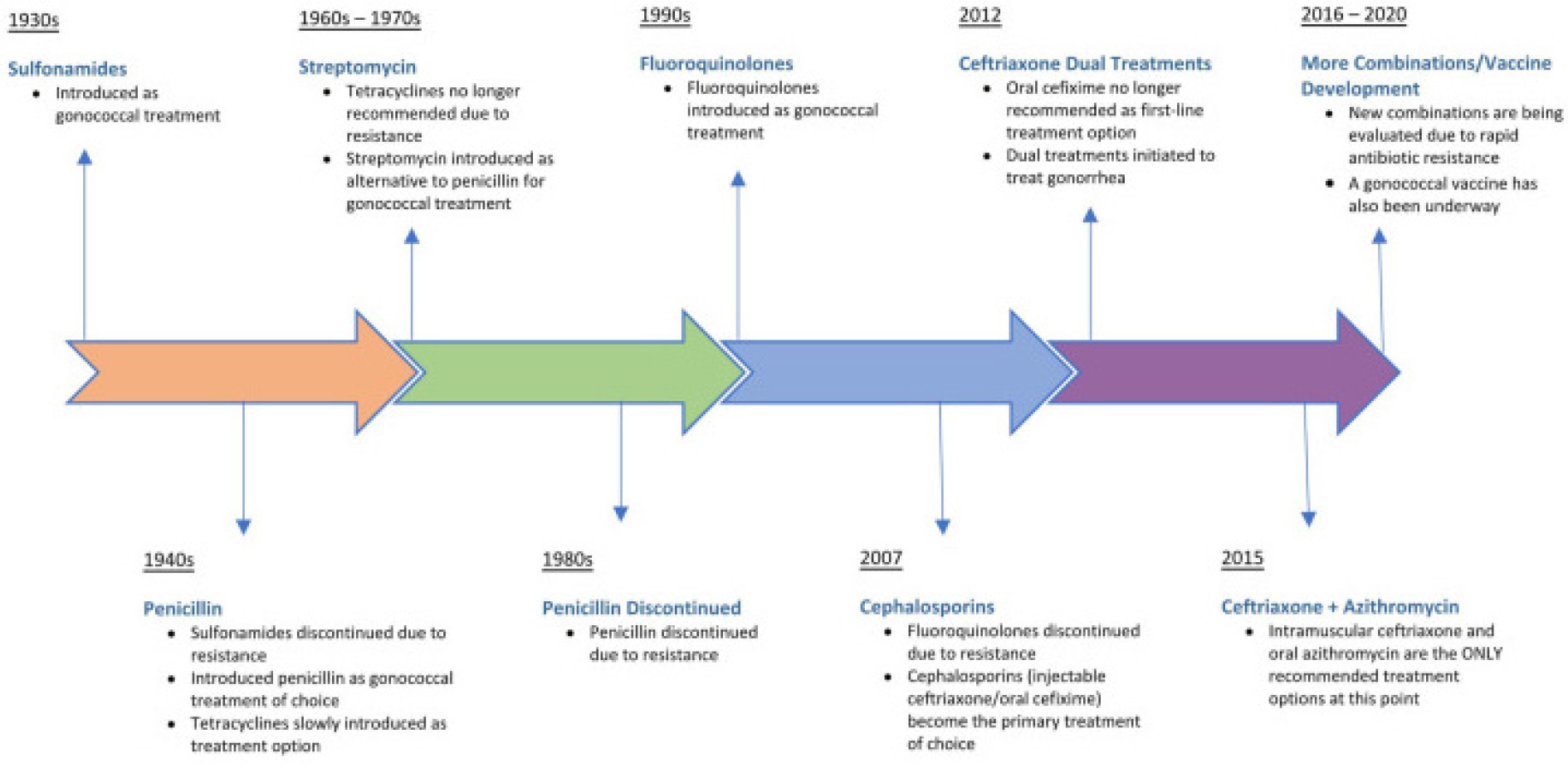
임균은 수세기에 걸쳐 여러 항생제에 노출되면서 광범위한 항균 약물에 대한 내성을 획득하였다.임균의 항생제 내성의 역학적 변화에 맞추어 임질 치료지침도 변화하였는데, [그림 1]은 1930년대 중반 sulfonamide가 도입된 이후 임질 치료를 위한 1차 항생제 요법의 변화를 보여준다. Sulfonamide, penicillin, tetracycline, fluoroquinolone 및 cephalosporin을 포함한 기존의 모든 경험적 단일 요법에 내성을 갖는 임균 균주가 전 세계적으로 출현하였다.
임질의 첫 번째 치료제인 sulfonamide에 대한 내성은 folP 유전자에서 획득한 돌연변이로 인해 발생하였으며, 이를 대체하며 1940년대 도입된 penicillin은 β-lactam 항생제를 비활성화하는 효소인 플라스미드 매개 β-lactamase를 보유하는 내성 균주가 출현할 때까지 수십 년 동안 효과적인 임질 치료제로 사용되었다. Tetracycline과 같은 대체 항생제도 임균 감염의 치료에는 효과적이었으나 리보솜 보호 단백질 TetM을 포함하는 내성 임균 균주가 발생하면서 임질 치료제로의 사용은 중단되었다.
Fluoroquinolone 중 1983년 등장한 ciprofloxacin은 부작용이 적으면서도 높은 효과를 보여 1980년대 임질의 치료제로 널리 사용되었다. Fluoroquinolone 치료 실패는 gyrA 및 parC 유전자의 돌연변이에 대한 내성의 결과로, 1990년대에 최초의 fluoroquinolone 내성 균주가 나타났고, 그 후 2009-2012년 내성 사례가 많이 보고되면서 유럽, 아시아 및 미국 등에서 ciprofloxacin의 사용이 중단되었다 [2]. 이에 따라 2007년 Centers for Disease Control and Prevention (CDC) 권장 지침에서 fluoroquinolone이 제외되고, 경험적 항임균 단독 요법의 마지막 보루로 extended-spectrum cephalosporins (ESCs)만 남게 되었다.
Ceftriaxone(주사제)과 cefixime(경구)은 임균 감염 치료에 세계적으로 가장 널리 사용되는 ESCs로 대부분의 국가에서 임질의 일차 치료제로 사용되기 시작하면서 내성이 있는 균주가 출현하기 시작하였다. 1990년부터 2000년까지 임질 치료를 위한 ceftriaxone의 사용은 승인되지 않았기 때문에 효과가 떨어지는 다수의 저용량 경구 cephalosporin이 사용되었는데, 이는 억제 농도보다 낮은 ESCs의 축적으로 cephalosporin의 내성 출현에 기여했을 것으로 추측된다. 1995년 일본 Kanagawa에서 처음 cefixime에 대한 내성 균주가 나타났고, 1996년부터 2002년까지 내성 균주의 사례가 57.1% 증가했다 [3]. 이후 2000년대 후반 일본 외 여러 유럽 국가들, 남아프리카, 캐나다 등 전세계적으로 cefixime을 사용한 치료 실패 사례가 보고되면서 2012년 이후 CDC가 치료 요법에서 cefixime을 제거할 것을 권고하였다.
이렇듯 sulfonamide에서 ESCs에 이르기까지 다양한 종류의 단일 치료제에 대한 임균의 항생제 내성은 임균 감염에 대한 1차 치료로서의 병합 요법의 개발로 이어졌다.
2.1.2. 현재의 치료 실패: 병합 요법(Ceftriaxone and Azithromycin)
2010년 이후 ceftriaxone과 azithromycin의 병합 치료 요법은 임균의 ceftriaxone에 대한 감수성 감소를 완화하고, 인두 임질을 포함한 임균 감염 치료 및 동반된 성매개감염의 치료에 효과적인것으로 입증되어 전세계적으로 사용되어왔다. 그러나 2016년에 병합 요법으로 인한 첫 번째 글로벌 치료 실패가 보고되었으며 2018년 영국과 호주에서 ceftriaxone 내성과 높은 수준의 azithromycin 내성이 결합된 첫 번째 분리주가 보고되었다 [4]. Ceftriaxone과 azithromycin 병합 요법에 대한 첫 번째 내성 균주의 경우 ceftriaxone MIC는 0.5 mg/L, azythromycin MIC는 > 256 mg/L 로, 높은 수준의 azithromycin 내성을 나타낸다. 최근 여러 연구에서 임균의 ESCs와 azithromycin 병용 요법에 대한 감수성이 감소하고 많은 국가에서 azithromycin에 대한 내성이 크게 증가하면서 이 병합 치료 요법은 더이상 유효하지 않게 되었다 [그림 2].
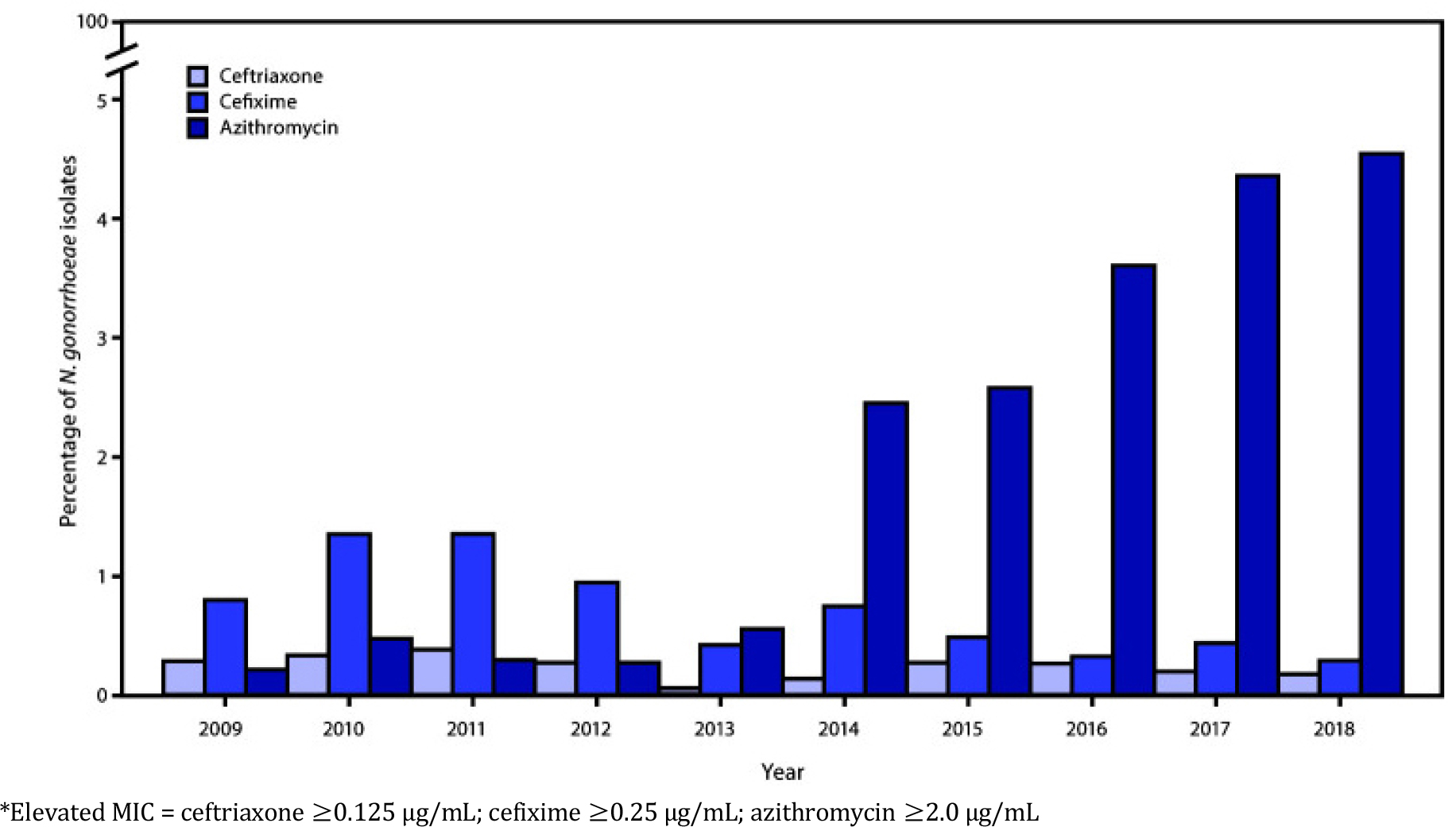
그림 2.
Ceftriaxone, cefixime 및 azithromycin에 대한 최소 억제 농도(minimum inhibitory concentration, MIC)가 증가한 임균 분리주의 백분율— Gonococcal Isolate Surveillance Project, 미국, 2009–2018 [5]
2.2. 임질 치료 지침의 변화(2020)
전세계적으로 높은 수준의 azithromycin 내성의 출현과 항균제 관리의 차원에서 임균 감염에 대한 병합 치료는 더 이상 권장되지 않는다. 2020년 변경된 CDC의 치료 가이드라인은 다음과 같다 [5].
자궁경부, 요도 및 직장의 임균 감염에 대한 권장 치료법은 단일 용량으로 ceftriaxone 500mg을 근육주사하는 것이며, 150kg을 초과하는 환자의 경우 ceftriaxone 용량을 1g으로 증량해야 한다.
Ceftriaxone을 사용할 수 없는 경우 gentamicin 240mg IM과 azithromycin 2g을 1회 경구 투여하거나 cefixime 800mg을 1회 경구 투여하는 두 가지 대체 요법이 있다.
Chlamydia 동시 감염을 배제할 수 없는 경우 doxycycline 100mg을 1일 2회 7일 동안 추가해야 한다.
임균 인두 감염은 특정 인구 집단에서 흔히 발생하며 지역사회 전파의 원인이 될 수 있다. 인두 감염은 생식기 감염보다 치료하기가 더 어려운데, 권장되는 인두 임균 치료 요법은 150kg 미만의 환자에게 단일 용량으로 ceftriaxone 500 mg을 IM, 체중이 150 kg을 초과하는 환자에게는 1g 투여를 권장한다. 대체 치료 요법은 권장되지 않으며, 인두 감염 환자는 치료 7-14일 후에 반드시 재검하도록 권장한다.
2.3. 다제내성 시대 임질의 치료
2.3.1. 새로운 치료제에 대한 연구
결과적으로 현재 사용 가능한 ceftriaxone 또한 장기적인 해결책이 아니며 임질의 향후 치료를 위한 새롭고 효과적인 항균제의 개발이 필수적이다. 몇몇 새로운 항균제들이 임균 균주에 대한 시험관 내 높은 활성이 확인되었지만 임상 데이터는 대부분 결여되어있다. 치료에 사용할수 있는 세균성 topoisomerase 억제제로서 3상 임상 시험에 도달한 세가지 새로운 항생제가 있으며, 이 중 zoliflodacin이 매우 유망한 것으로 보인다.
Zoliflodacin은 spiropyrimidinetrione에 속하는 항생제로 ciprofloxacin과 유사한 작용 기전을 가지고 있지만 Mg2+ 이온을 사용하지 않아 ciprofloxacin 내성 균주에 효과적인 것으로 나타났다. Zoliflodacin은 임균 균주에 대한 빠른 성장 억제를 나타내어 ceftriaxone에 내성을 가진 균주를 포함하여 강력한 시험관 내 활성을 보여주었는데, ceftriaxone과는 유사하면서 이전에 사용된 모든 항균제에 비해서는 전반적으로 더 낮은 MIC를 보였다 [6]. 2015년 완료된 미국의 2상 임상 시험에서 zoliflodacin 2 g과 3 g 투여시 비뇨생식기 임질은 각각 98%와 100%, 직장 임질은 100%, 인두 임질은 67%와 78%의 치료 성공률을 보였다 [7]. 인두 임질을 제외하고, zoliflodacin은 효과적이고 내약성이 좋은 것으로 보이며 부작용은 일시적인 위장 장애 정도이다.
Solithromycin은 최근 몇 년 동안 광범위하게 연구된 원핵생물 리보솜 부위를 표적으로 하는 4세대 광범위한 macrolide이다. 시험관 내 연구에서 두 개의 다제내성 균주 H041 및 F89를 포함하는 임균 분리주에 대해 현재 사용되는 항생제보다 우수한 항생제 활성이 밝혀졌으며 [8], solithromycin 1200 mg 및 1000 mg 경구 용량을 사용한 2상 임상 시험에서 생식기, 구강, 직장 모두에서 100% 효능을 보였다 [9]. 그러나 solithromycin 대 ceftriaxone 및 azithromycin 이중 요법을 조사한 SOLITAIRE-U 3상 임상 시험 결과, 제균률 차이(80% 대 84%)에서 4.0% 낮은 차이로 비열등성을 나타내지 못했다. 따라서 임균 균주에 대한 1차 치료제로서의 가능성에 대해서는 추가 평가가 필요하다.
Gepotidacin은 triazaacenaphthylene 계열의 새로운 항생제로 quinolone을 비롯한 기존 항생제와는 다른 기전을 통해 세균의 DNA gyrase와 topoisomerase IV를 억제하는 작용을 한다. Gepotidacin은 시험관 내 연구에서 다제 내성 균주를 포함하여 모든 임균 균주에 대한 강력한 활성을 보여주었으며 [10], 다른 어떤 항생제에서도 교차 내성이 발견되지 않았다. 2상 임상 시험에서는 비뇨 생식기, 인두 및 직장 부위에서 96%의 치료율을 보여 [11], 이러한 유망한 결과로 경구 gepotidacin 대 IM ceftriaxone 및 azithromycin 이중 요법을 비교하는 3상 임상 시험을 시작했다.
한편, 새로운 작용 기전을 가진 임질 치료제의 또 다른 후보인 작은 항균 분자 SMT-571은 다제내성 균주를 포함하는 모든 임균 균주에 대해 시험관 내 높은 활성을 보였다. 그외에도 이전에 사용되던 항생제들이 임균 치료에 효과를 보였는데, delafloxacin, sitafloxacin 등의 새로운 fluoroquinolones 및 tetracyclines, carbapenems, macrolides 등이 포함된다. 기존 약물과 신약을 단독, 병합하여 사용하는 것 외에도 프로바이오틱스 또는 박테리오파지를 사용한 대체 요법이 고려되고 있다.
2.3.2. 백신의 개발
임질에 대한 백신은 20세기 초부터 연구되었지만, 다양한 항원의 변이, 면역 회피의 다중 기전, 숙주의 제한 등으로 인해 백신의 개발에 어려움을 겪고 있다. 일부 백신이 임상 시험에 들어갔으나 모두 실패했고, 최근 LOS 유래 epitope 2C7을 사용한 동물 실험에서 유망한 결과를 얻었다. 흥미로운 사실은 혈청군 B 수막구균에 대한 예방접종을 받은 사람이 임질에 대해 부분적으로 면역이 있는 것으로 밝혀져 [12], 효과적인 백신 개발이 임박했다는 기대를 주고있다. 그러나 후보 백신들이 다양한 병원성 임질을 예방한다는 것을 검증하기 위해서는 상당한 작업이 남아있다.