1. 서론
2. 감염
2.1. 급성 신우 신염(Acute pyelonephritis, APN)
2.2. 만성 신우 신염(Chronic pyelonephritis, CPN)
2.3. 신실질 질환(Renal parenchymal disease)
2.4. 신동맥 협착증(Renal artery stenosis)
2.5. 신실질 종양
1. 서론
비뇨의학과 개원의들이 시행하는 신장 초음파 검사가 증가하여 수익을 창출하고 있다. 그러나 전공의 과정에서 이론과 실기를 제대로 배우기가 매우 어려운 실정이다. 평균 수명이 증가함에 따라서 신장 질환자는 그 숫자가 매년 증가하고 있기 때문에 신장 초음파 중요성이 부각되고 있다. 염증, 감염, 종양 등을 감별하려면 환자의 증상과 소변 검사, 혈액 검사 등을 같이 고려해야 하지만 그 구별이 쉽지 않은 경우가 적지 않다. 신장 초음파 검사를 시행하면 대부분의 증례에서 정상과 비정상을 구분할 수 있기 때문에 정상과 비정상 초음파 소견을 숙지하고 신장 초음파 검사를 시행해야 한다. 이 종설에서는 흔히 접할 수 있는 신우 신염, 신실질질환, 신동맥 협착증, 양성 종양, 악성 종양 등의 초음파 소견을 제시하려고 한다.
2. 감염
2.1. 급성 신우 신염(Acute pyelonephritis, APN)
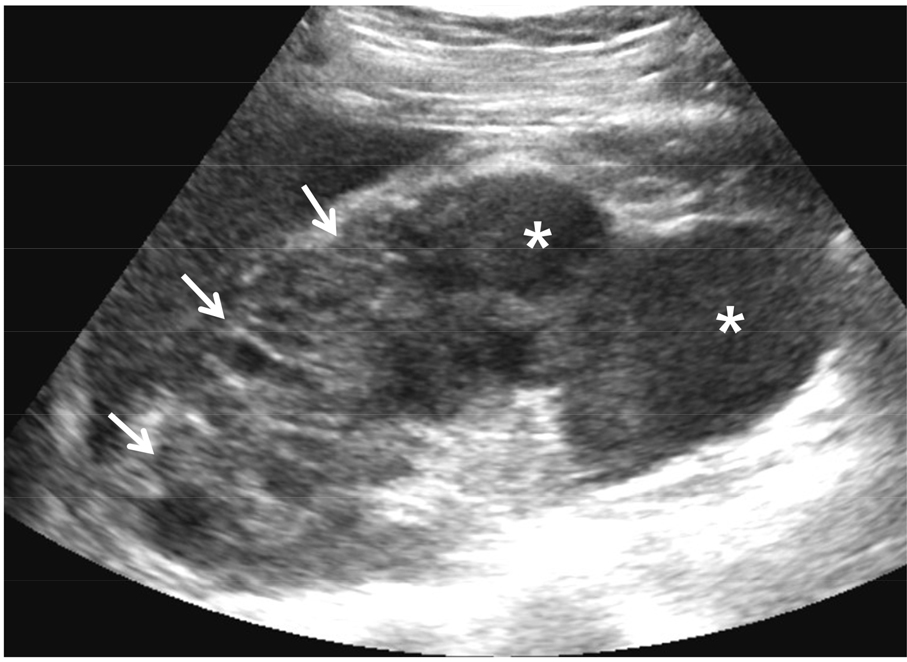
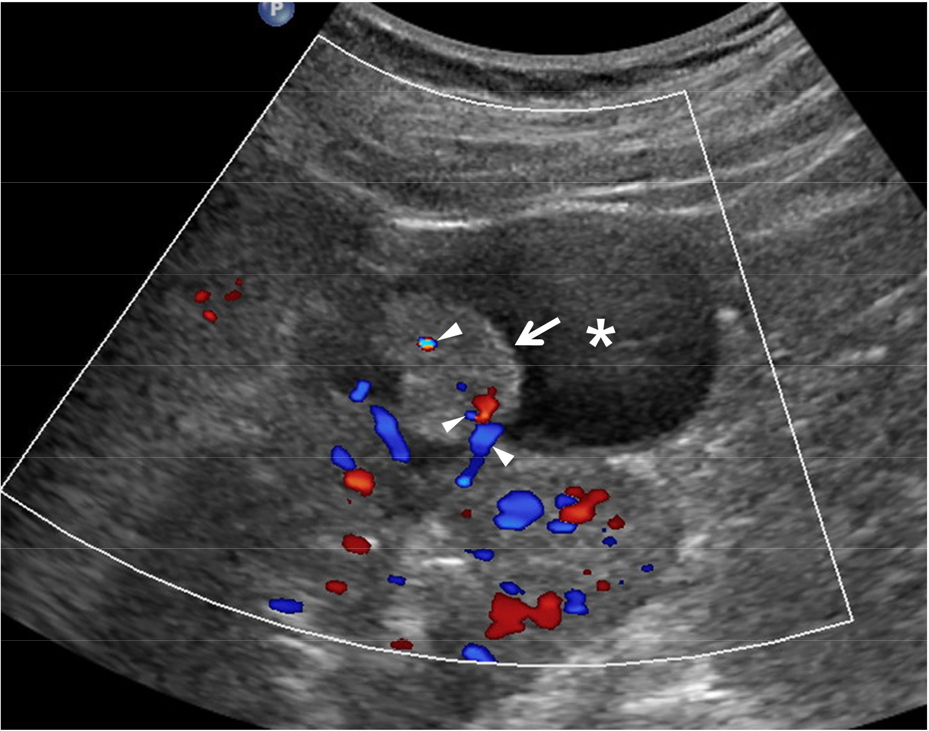
환자가 고열, 측복통, 빈뇨, 배뇨통 등을 호소하고 소변 검사에서 농뇨(pyuria)가 진단되면 신우 신염, 방광염, 요도염 등을 의심할 수 있다. 초음파는 필수 검사가 아니기 때문에 반드시 시행할 필요는 없지만 요로 폐색, 농양, 액체 저류 등이 있는지 확인하는 것이 치료 예후를 예측하는데 중요하다. 이러한 소견이 있다면 통상적인 항생제 치료로는 요로 감염이 해결이 되지 않고 패혈증으로 악화될 수 있다. 또한, 잘 조절되지 않는 당뇨병, 만성 질환자, 면역 저하자, 임산부 등은 상기 소견이 없더라도 유두 괴사, 농양 형성 등으로 진행할 수 있다 [1,2,3] [그림 1]. 그러므로 가급적 모든 환자에서 초음파 검사를 시행하여 상기 소견 유무를 확인할 것을 권장한다.
신우 신염이 있는 경우 거의 모든 경우에서 신장 부종이 발생하기 때문에 다양한 정도의 신장 크기 증가가 발생한다 [1,2]. 초음파상 신장 크기와 모양이 다양하여 초기에는 정상 크기와 모양을 유지할 수도 있다. 신피질 에코는 정상이거나 보다 낮아질 수 있고 높아지지는 드물다. 만약 높아졌다면 상당히 신우 신염이 악화되어 비가역적 신실질 손상을 의미하는 경우이다. 부종이 심해지면 혈류가 감소하기 때문에 색도플러 검사상 신장내 관류가 저하된다. 경증의 수신증은 매우 흔하며 요로 폐색 없는 경우가 대부분이다. 요로 폐색이 동반될 경우 수신증 정도가 비교적 증가하고 calyceal blunting, 요관 확장 등이 동반된다. 특히 소변의 에코가 증가되고 부유물의 이동 및 침착, 소변 내에 공기를 의심케 하는 shadowing이 있다면 pyonehrosis를 강하게 시사하는 소견이기 때문에 응급으로 PCN (percutaneous nephrostomy)를 시행해야 한다 [4].
결론적으로 기저질환이 없는 급성 신우신염 환자가 초음파 소견상 정상 또는 약간의 신부종만 보일 경우 안심하고 항생제 처방하고 추후 재방문시 증상의 호전, 소변 검사에서 농뇨가 사라졌는지 확인하면 된다.
2.2. 만성 신우 신염(Chronic pyelonephritis, CPN)
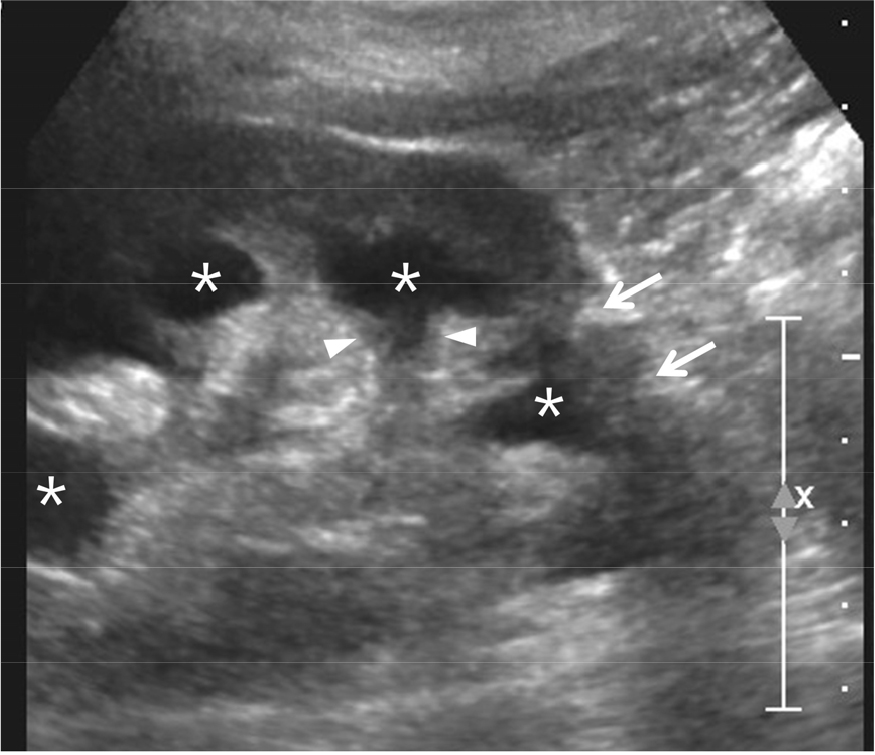
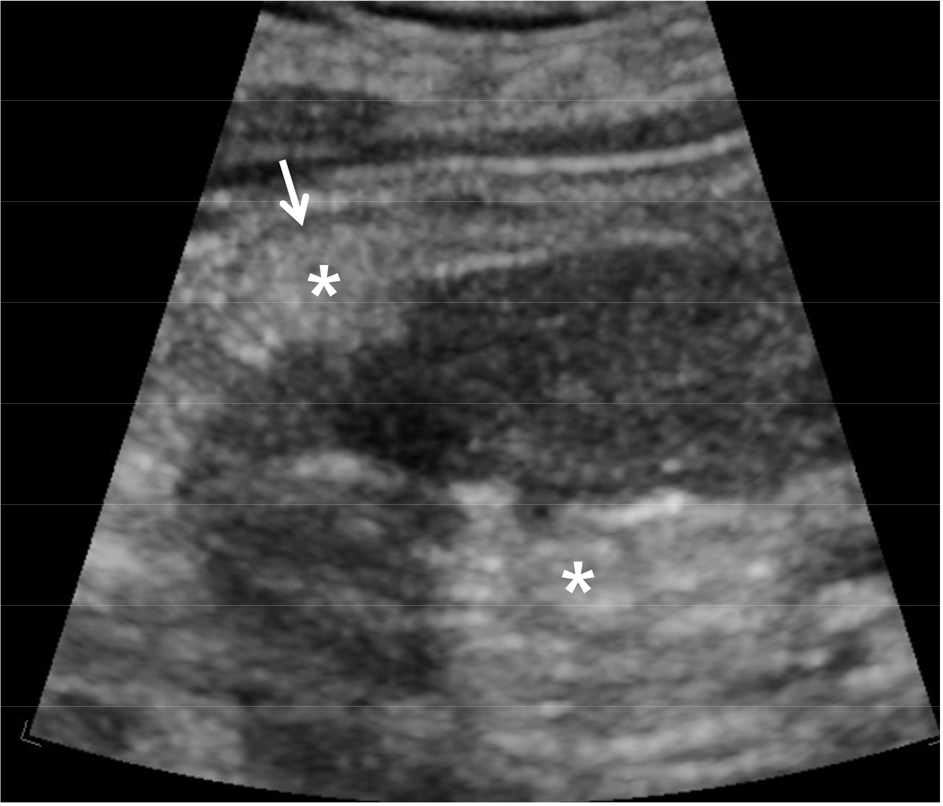
반복되는 요로 감염 때문에 신장 내에 비가역적 손상이 발생하면 해당 신실질이 위축되고 calyx의 모양이 변형된다. 그러므로 초음파 검사상 hydrocalyx가 보이며 fornix가 넓어져서 clubbing이 발생한다 [3,5,6]. 또한 인접한 신실질이 위축되어 얇아지며 주변 정상 조직이 비대해질 수 있다 [3,5,6] [그림 2]. 이러한 소견이 반복되면 신기능이 감소하며 요로 감염이 잘 조절되지 않음을 의미한다. 이런 경우 방광벽도 두꺼워지기 때문에 신장 뿐만 아니라 방광도 초음파 검사를 해야 한다.
2.3. 신실질 질환(Renal parenchymal disease)
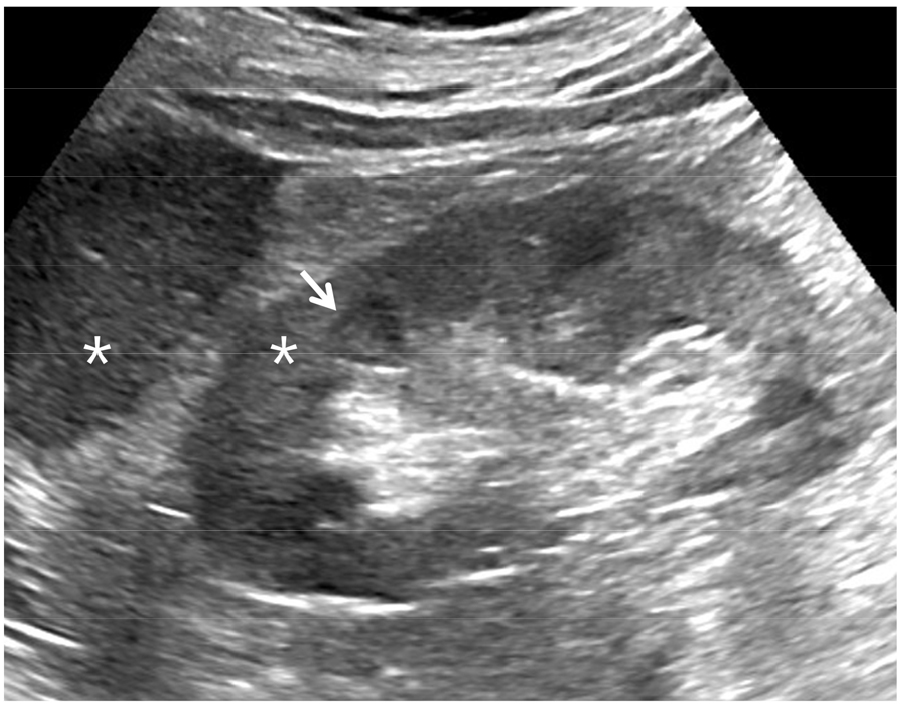
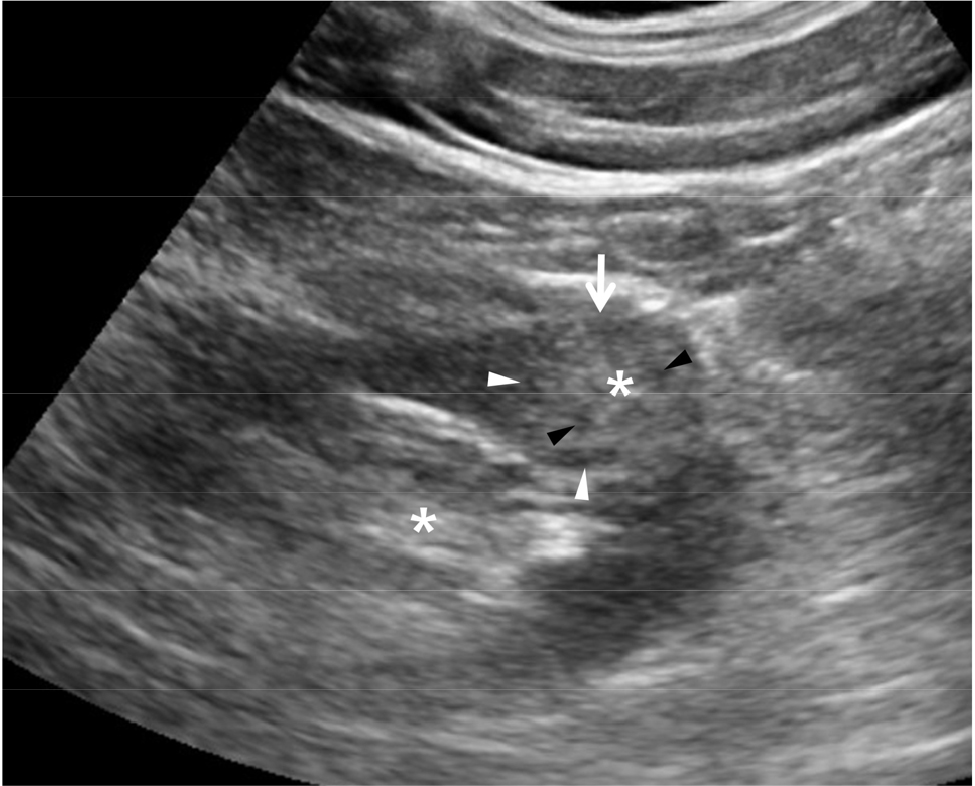
신실질에 사구체신염, 간질성 신염, 혈관성 신질환 등이 발생하면 신실질에 염증이 발생하여 신기능의 감소가 발생한다 [7]. 급성 염증이 발생하면 신장의 크기가 부종 때문에 증가하고 신피질의 에코는 정상이거나 감소한다 [7,8]. 그러나 만성 염증시 신피질의 에코가 증가되고 신장의 크기가 감소한다 [그림 3]. 신피질의 에코가 증가하면 피질과 수질의 경계가 더욱 뚜렷해진다 [7,8]. 초음파 검사는 신장 크기를 정확히 측정하여 조직 검사를 가능 여부를 결정하며 신피질의 에코의 증가 유무를 판단한다. 신장 크기의 감소와 신피질 에코의 증가는 양측 신장 모두 대칭적으로 발생한다. 그러므로 비대칭적인 신장 크기 감소와 신피질 에코의 증가는 신장 동맥 협착의 동반 가능성을 배제해야 한다. 신장 동맥을 도플러 초음파로 검사하여 협착 유무를 결정해야 한다 [9,10,11].
2.4. 신동맥 협착증(Renal artery stenosis)
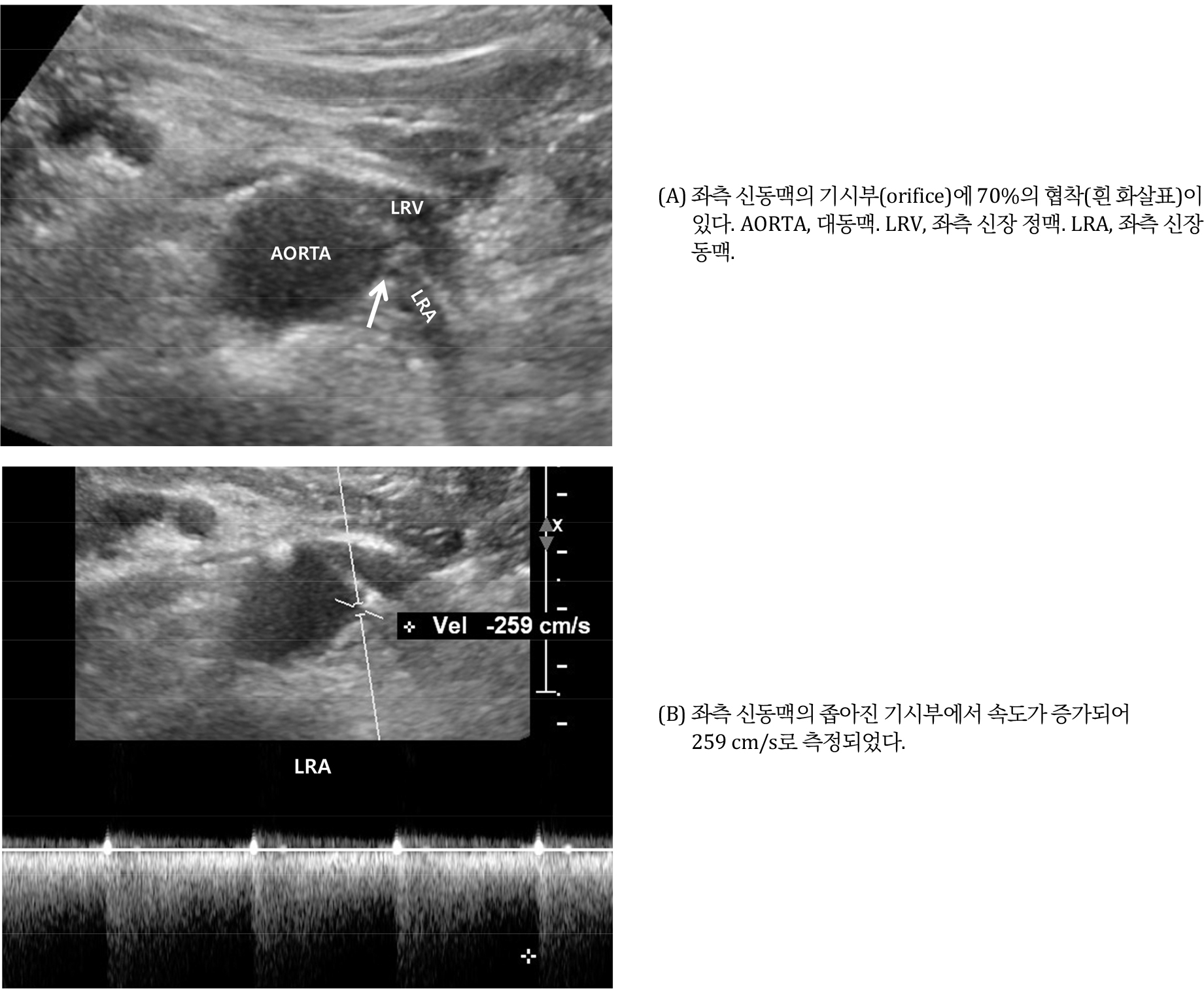
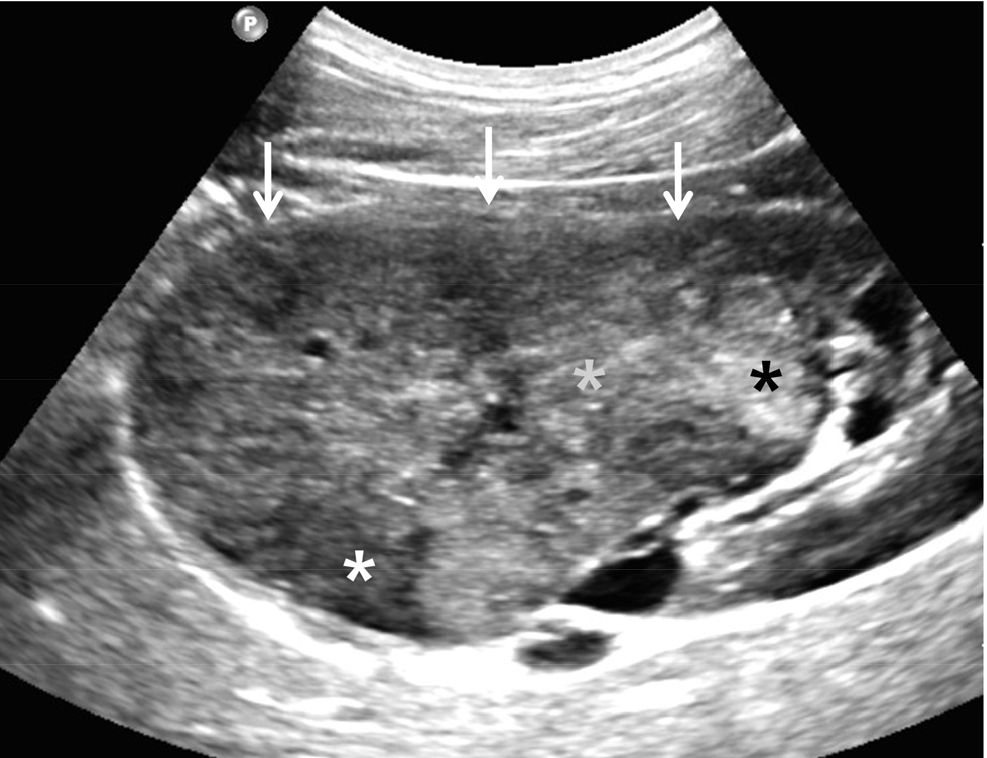
신동맥 협착증은 비교적 흔한 질환이며 고혈압, 신장 기능 감소 등을 일으키지만 조기에 발견하면 혈압을 낮추고 신기능의 악화를 막을 수 있다. 초음파 검사로 신장 동맥을 발견하기가 쉽지 않지만 좌신 정맥을 먼저 찾으면 쉽게 해결될 수 있다 [9,10,11]. 환자의 숨을 참게 하지 말고 배가 부드럽게 눌려서 후복막강과 거리를 좁혀야 한다. 좌신 정맥을 찾으면 후방 및 주변에 양측 신장 동맥이 있기 때문에 각각의 신장 동맥을 찾아서 동맥 기시부와 근위부에서 협착 유무를 판단한다. 회색조 초음파도 협착 유무를 찾을 수 있지만 색도플러 초음파를 시행하면 협착 부위를 더 정확하게 찾을 수 있다 [9]. 스펙트럼 도플러 초음파(Spectral Doppler US)로 좁아진 부위의 혈류 속도를 측정하면 180 cm/s가 넘을 경우 신동맥협착을 진단할 수 있다 [9,10] [그림 4]. 대동맥의 혈류 속도를 측정하고 신장 동맥 속도가 2.5 – 3배 이상으로 대동맥 혈류 속도에 비교하여 증가된 경우도 신동맥협착을 진단할 수 있다 [9,10,11]. 그러나 협착이 심하면 초음파 신호가 약하거나 혈류 측정이 기술적으로 어려울 수 있다. 이런 경우 협착 후방의 넓어진 동맥 내에서 혈류를 측정하여 180 cm/s 이상 측정되거나 대동맥 혈류 속도보다 2.5 – 3 배 이상 증가 되면 신동맥 협착증을 진단할 수 있다 [9].
2.5. 신실질 종양
2.5.1. 양성 종양(benign renal tumor)
신실질에서 발생하는 양성 종양은 대부분 Bosniak I과 II 낭종이다. 이 종양은 낭벽과 격막이 매우 얇고 미세한 석회화가 동반될 수 있다 [12,13]. 얇은 정도는 낭벽이 머리카락 두께를 의미하며 2 mm 이상 두꺼워지면 IIF 이상의 낭종이기 때문에 암일 가능성이 5% 미만이지만 CT 검사를 시행해야 한다 [12,13]. 또한 낭벽과 격막이 두꺼울 뿐만 아니라 불규칙하면 Bosniak III 낭종이고 내부에 고형 결절이 발생하면 Bosniak IV 낭종이다 [12,13] [그림 5]. 이러한 경우 암일 가능성이 50 – 90%이기 때문에 반드시 CT검사를 시행해야 한다.
초음파 검사상 종괴의 에코가 인접한 신피질 보다 증가 되면 고형 종괴로 판단할 수 있다. 그러나 출혈이 있는 낭종인 경우도 에코가 증가되기 때문에 고형 종괴와 구분해야 한다 [13]. 색도플러 검사시 종괴내 혈류가 존재하면 고형 종괴로 인지하면 된다. 혈류가 보이지 않는 고형 종괴는 역시 출혈 낭종과 감별이 어렵다. 이런 경우 개원가에서 초음파 조영제를 시용하면 종괴 내 혈류 유무를 쉽게 구분할 수 있다 [그림 5]. CT 또는 MRI 조영제와 달리 부작용이 거의 없으며 신장 기능이 감소된 환자에서 사용이 가능하다 [13].
양성 고형 종괴는 혈관근지방종, oncocytoma 등이 대표적이지만 동양인에게는 혈관근지방종이 압도적으로 흔하다 [14,15,16]. 그러므로 고형 종괴로 판단될 경우 혈관근지방종과 신세포암의 감별이 제일 중요하다. 지방이 많은 혈관근지방종은 신세포암과 비교할 때 에코가 상대적으로 높아서 흔히 신동(renal sinus) 에코와 비교시 같거나 높은 경우가 많다 [17,18] [그림 6]. 에코가 높을수록 종괴 후방으로 초음파 투과가 어렵기 때문에 후방 그림자(posterior shadowing)도 비교적 흔히 볼 수 있다 [19]. 그러나 종양 내 지방이 감소하면 종양의 에코가 감소하기 때문에 신세포암과 감별이 어려워지며 CT 또는 MRI를 시행해야 한다. 내부에 낭성 변화, 괴사, 석회화 등은 매우 드물기 때문에 이런 소견이 동반되면 신세포암을 먼저 고려해야 한다 [15].
2.5.2. 악성 종양(Malignant renal tumor)
신실질에서 발생하는 악성 종양 중에 가장 흔한 것은 신세포암이다. 그래서 신장 초음파를 시행할 경우 신세포암의 소견을 잘 숙지 해야 한다. 4 cm 미만의 소신세포암은 신피질과 비교하여 에코가 증가된다 [20]. 그러므로 종괴 처럼 보이지만 주변과 신피질과 같은 에코라면 신세포암이 아닐 가능성이 높다 [21,22,23]. 소신세포암은 저분화암(low grade cancer)이 흔하며 대개는 주변을 누르면서 자라기 때문에 가짜 피막(pseudocapsule)의 형성이 매우 흔하여 저에코의 테두리가 종괴 주변에 보인다 [24,25,26] [그림 7]. 또한 종양 내부에 낭종이 흔히 보이는 것도 특징이다 [24,25,26].
4 cm 이상의 대신세포암은 내부에 괴사, 낭성변화, 출혈 등이 흔하기 때문에 소신세포암에 비해 국소적으로 에코가 증가하여 비균질적으로 보인다 [27,28,29] [그림 8]. 또한 정맥 혈전이 발생할 경우 정맥이 커지며 약간 코에코의 종양 혈전이 보인다 [29]. 회색조 초음파와 색도플러 초음파 검사로 신정맥과 하대 정맥 내에 종양 혈전을 발견하는 것은 어렵지 않다 [29]. 간, 임파절, 췌장 등에 전이한 종양 또한 크기와 개수가 증가되면 초음파 검사로 진단이 가능할 수 있다.