1. 서론
2. 본론
2.1. 증례로 본 M. genitalium에의한 만성 감염
2.2. Coronavirus (Covid-19)의 교훈; Covid-19 사례를 통해 만성 재발성 M. genitalium 감염기전 이해
2.3. 만성 재발성 M. genitalium 감염에 제시되는 기전
2.4. 증례로 본 32세 남자 환자의 추정되는 M. genitalium 만성 감염 기전
3. 결론
1. 서론
Mycoplasma genitalium은 여성에 있어서 자궁 경부염, 골반 염증, 조산, 유산 등을, 남성에서는 요도염 및 부고환염 등을 유발한다. M. genitalium은 세포벽이 없어 penicillin이나 cephalosporin 계통의 항생제로는 치료되지 않고, 2세대 fluoroquinolone인 ciprofloxacin이나 levofloxacin에도 태생적으로 내성을 보인다. Azithromycin이나 moxifloxacin에만 치료될 수 있으나, 최근 두 항생제에 내성을 보유한 super-bug 형태의 감염균이 전세계적으로 은밀하게 퍼지고 있다. 따라서 항생제에 내성을 보이는 M. genitalium에 감염된 일부 환자에서는 그 치료가 어렵고 재발이 잦아 만성 감염으로 진행되므로 환자가 받아들이는 심리적인 좌절감은 매우 크다고 할 수 있다. 본 원고는 치료되지 않고 재발되는 만성 M. genitalium 감염의 다양한 기전을 설명하여 진료를 담당하는 의료진에게 만성 감염 기전 이해의 폭을 넓혀 환자 진료에 도움이 되었으면 한다.
2. 본론
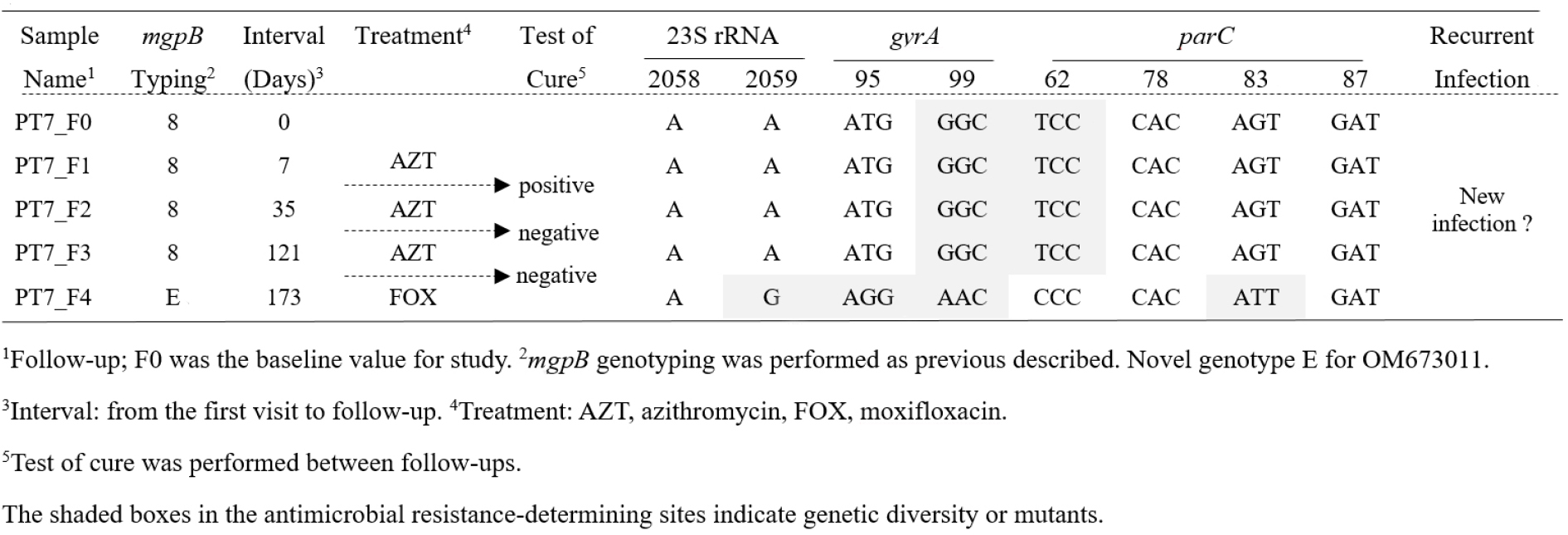
2.1. 증례로 본 M. genitalium에의한 만성 감염 [3] [표 1]
32세 남자가 재발하는 M. genitalium 요도염으로 본원에 전원되어 왔다. 개원가에서는 doxycycline, azithromycin을 사용하였지만, 치료가 끝나고 1-2달이 지나면 다시 요도염 증상이 재발하였고 이때 시행한 유전자 검사에서 M. genitalium이 다시 검출되었다고 하였다.
본원 내원 첫날(F0)에 시행한 항생제 내성 검사에서 azithromycin이나 moxifloxacin대한 내성유전자 변이는 없었다. 7일이 지나(F1) azithromycin을 3일에 거쳐 총 1.5gm을 처방하였다. 2주 후 증상은 좋아졌지만, 시행한 완치 검사(test of cure; TOC)에서 다시 양성으로 진단되었고 유전자 검사에서 1차 검사와 동일한 유전자형(mgpB type; 8)과 동일한 항생제 내성이 관찰되어 임상적으로는 치료에 실패하였지만, 재발된 세균은 azithromycin에 내성이 없는 것으로 판단되어 5주가 지난 시점(F2)에 F1와 동일하게 azithromycin을 다시 처방하였다. 그 후 시행한 TOC 검사에서 음성으로 진단되었다. 121일이 지난 후(F3) 환자가 경미한 요도 자각 증상을 보여 시행한 요검사에서는 고배율시하 하에 백혈구는 1-4개, 유전자 검사에서 동일한 유전자형인 M. genitalium 양성, 항생제 내성 검사에서는 동일한 내성 결과를 보여주었다. 이 때에도 F1, F2와 같이 azithromycin을 다시 처방하였다. 그 후 시행한 TOC 검사에서 음성으로 전환되었다.
173일이 지난 시점(F4)에 환자는 심한 요도 통증을 동반한 농 유출로 다시 내원하였으며, 그 때 시행한 유전자 증폭법에서 azithromycin과 moxifloxacin에 내성 유전자를 동반한, 전세계적으로 보고된 적이 없는 새로운 유전자형(E형; 저자가 미국국립보건원에 신고해 OM673011으로 새로운 genotyping을 명명 받았음)의 M. genitalium이 검출되었다.
32세 남자의 병력을 이해하기 위해 M. genitalium의 재발에 관여하는 기전을 추정해 보자.
2.2. Coronavirus (Covid-19)의 교훈; Covid-19 사례를 통해 만성 재발성 M. genitalium 감염기전 이해
2.2.1. 항원의 변이
코로나바이러스의 면역은 항원을 결정하는 바이러스 표면에 위치한 스파이크 단백질의 유전자 염기서열에 의해 결정되는데, 이러한 염기서열에 변이가 발생한다면 기존 감염으로 얻은 자연면역이나 백신 요법에 따른 인공면역 모두를 회피할 수 있어 쉽게 재감염이 일어날 수 있다. RNA 바이러스의 일종인 코로나바이러스는 단일 염기서열을 가지고 있어 태생적으로 변이가 쉽게 발생되며, 이러한 변이는 자가 수복기전(repair mechanism)에 의해 쉽게 수정되지 않는다. M. genitalium의 유전자도 코로나바이러스와 같이 단일 염기서열을 가지고 있어 유전자의 변이가 비교적 쉽게 발생한다.
2.2.2. TOC 검사의 민감도
유전자 증폭법은 이론적으로는 1개 미생물의 핵산이 40회 증폭되면 그 수가 240 증폭되어 진단이 가능할 것처럼 보이지만, 실제로는 배경(noise) 등의 영향으로 진단은 일정한 갯수 이상인 미생물 양에 의해 결정된다. 코로나바이러스 유행 초기에 방역에 혼란을 야기한 TOC 검사의 위음성은 감염량이 적은 검체를 사용함으로써 발생하였다. 저자의 연구에 따르면 M. genitalium 감염환자 첫 소변의 그 감염량(bacterial load)은 Chlamydia trachomatis 감염환자의 C. trachomatis의 감염량에 비해 10배 정도 낮게 관찰되었다. 특히 항생제 투여 후 real-time PCR법을 이용해 TOC 검사를 시행해 보면 검출되는 M. genitalium의 양은 Ct 값이 35-38정도로 매우 낮게 관찰되었다. 따라서 TOC 검사가 낮은 Ct 값 즉 미량의 감염균을 진단할 수 없다면 항생제 치료에 살아남은 소량의 M. genitalium이 항생제 효과가 없어지는 시점에 다시 증폭해 증상 발현 및 검사에서 다시 양성으로 진단될 수 있다. 따라서 덴마크의 Jessen 교수가 주장하는 것처럼 M. genitalium 추적 검사는 민감도가 매우 높고 공인받은 검사 방법을 사용하여야 한다.
2.3. 만성 재발성 M. genitalium 감염에 제시되는 기전
만성 감염의 특징적인 소견은 항생제 치료 직후에는 증상이나 증후가 일시적으로 호전되었다가 시간이 지남에 따라 증상이나 증후가 재발되고, 치료 후 초기 TOC 검사에서 음성으로 나왔다가 약물 효과가 없어지는 후기에는 다시 양성으로 진단되기도 한다.
2.3.1. M. genitalium에 의한 persistent infection(지속 감염)
지속 감염은 1차 감염과 동일한 유전자형(genotype)의 M. genitalium이 지속적으로 관찰되는 것으로 azithromycin이나 moxifloxacin 같은 다양한 항생제 치료에도 사멸되지 않고 숙주 체내에 숨어 있다가 재발되는 것으로 정의할 수 있다. M. genitalium의 지속 감염에 관여할 기전에 대해 알아보자.
(1)M genitalium은 태생적으로 azithromycin이나 moxifloxacin 등 2-3 항생제에만 치료되는 extensive resistance를 보이고 현재 일부 환자에서는 모든 약제에 치료될 수 없는 pan-drug resistance로 진행 중에 있다. 따라서 치료 약물에 내성이 발생하였거나 super-bug로 진화한 M. genitalium 균은 항생제 치료에도 동일한 균이 지속적으로 관찰된다.
(2)M. genitalium은 세균 중 그 크기가 가장 적어 오래전부터 숙주 세포 안에 숨어들 가능성이 제기되어 왔으며, 일반적으로 Mycoplasma spp.는 숙주 세포내 생존이 가능하고 세포 내에서 숙주-기생충 상관관계를 통해 생존함이 많이 연구되고있다. 숙주 세포 내 세균의 침투는 세포 외부에 분포되어 있는 항생제에 노출되지 않아 치료에 죽지 않고 생존할 수 있으며, 세포 내에서 안정적으로 숙주로부터 영양분을 섭취, 생존하는 장점이 있다. 또한 Krieger 등은 특발성 만성 전립선염(idiopathic chronic prostatitis) 환자의 회음부 전립선 조직검사에서 얻은 전립선 검체에서 M. genitalium의 유전자가 존재함을 발표하였다. 잘 알려진 것과 같이 전립선 내 세균 감염은 항생제가 잘 침투되지 않아 장기간 치료가 필요하다. 이론적으로 M. genitalium이 전립선 세포 내로 침투가 일어난다면 침투된 M. genitalium은 제한된 항생제가 전립선에 잘 침투되지 않아 사멸하지 않고 지속적으로 요로생식기감염을 유발할 가능성이 있다.
(3)Azithromycin이나 moxifloxacin에 저항이 발생된 M. genitalium의 경우 이러한 항생제 치료로 사멸되지 않고 단지 일시적으로 감염량이 감소되고 환자는 증상이나 증후가 호전되어 일시적으로 완치되는 것처럼 보여지기도 한다. 이때 사용되는 TOC 검사의 민감도가 낮아 미량의 잔존 미생물을 검출할 수 없다면 환자 자신뿐만 아니라 진료를 담당하는 의료진 또한 완치된 것으로 판단할 수 있을 것이다. 항생제 효과가 없어지는 시점에 미량의 병원균이 증폭되어 다시 증상이 재발되어 환자나 진료를 담당하는 의료진은 지속감염보다는 재감염으로 판단하기도 한다. 위에 기술한 것과 같이 저자가 경험한 일부 M. genitalium 환자의 경과 관찰에 의하면, 본원 내원 전 상기 병원균의 진단과 항생제 치료, 그 후 TOC 검사를 통한 완치 판정을 받았고 그 이후 성교가 없었거나 성교시 콘돔 등을 사용하여 재감염을 철저히 예방하였지만, 일정한 시간이 지난 후 증상이 재발되어 시행한 검사에서 동일한 유전자 형인 M. genitalium의 재발이 확인된 경우가 있었다. 일부 의료진은 이러한 현상을 M. genitalium에 의한 만성 전립선염에서 재발되었을 가능성으로 설명하였으나, 이런 현상은 여성에서도 발견되고 있어 다른 가능성 또한 생각해 보아야 한다. 저자 생각으로는 현재 우리나라에 사용되고 있는 M. genitalium의 TOC 검사의 낮은 민감도나 치료 후 3주 이전에 시행한 TOC 검사 시기도 이러한 혼란에 일조한 것으로 추정하고 있다.
2.3.2. M. genitalium에 의한 new infection(재감염)
재감염은 처음 감염된 M. genitalium은 완치되고 다른 유전자형(genotype)의 M. genitalium에 의해 다시 감염되는 것으로 정의될 수 있다. M. genitalium의 재감염에 관여할 기전은 다음과 같다. 일반적으로 미생물에 의한 감염은 시간이 경과함에 따라 숙주 면역 기전의 작동으로 자연 치유된다. 예를 들면 C. trachomatis에 의한 요도염인 경우 약 6개월이 지나면 요도협착 같은 합병증이 발생되기도 하지만, 대부분 자연치유되는 것으로 알려지고 있다. 그러나 일부 미생물의 경우 예외적으로 재감염으로 진행되는데 대표적인 예가 코로나바이러스에 의한 감염 및 매독균에 의한 감염 등이다.
(1) 코로나바이러스나 매독균에 의한 재감염
대중 매체를 통해 많이 알려진 것과 같이 코로나바이러스는 진화의 압력(evolutional pressure)에 따라 항원을 결정하는 스파이크 단백질의 유전자 염기서열의 변이가 빈발하게 발생해 기존 감염으로 얻은 자연 면역이나 백신 요법에 따른 인공 면역 모두를 회피할 수 있어 쉽게 재감염이 발생할 수 있다. 다른 예로는 Treponema pallidum에 의한 매독이 있다. 매독의 병기는 1기, 2기 3기 등이 순차적으로 발생되는데 특이한 것은 3기 매독이 발생하기 전에 1, 2기 매독 병변이 자연 소멸된다. 면역 기전을 통해 매독균에 의해 발생한 음경이나 음부 및 피부 병변 내 매독균은 소멸되지만, 일부 균은 사멸되지 않고 인체 장기에 침투해 3기 병변을 유발한다. 이러한 것은 T. pallidum의 면역을 결정하는 TprK 유전자의 변이와 관계가 있다. 결론적으로 코로나바이러스나 매독균과 같이 면역을 결정하는 항원 부위 유전자의 변이가 발생하면 백신을 접종하거나 감염 후 자연치유되어 항체가 발생하여도 변이된 미생물에 의해 재감염이 발생할 수가 있고, 이러한 변이에 의한 감염은 기존 항체에 의해 사멸, 예방되지 않고 장기간 생존해 만성 감염과 이어지는 합병증을 발생시킬 수 있다. 이러한 항원 변이 현상은 M. genitalium에서도 발견된다 [그림 1].
(2) M. genitalium의 항원 부위 변이
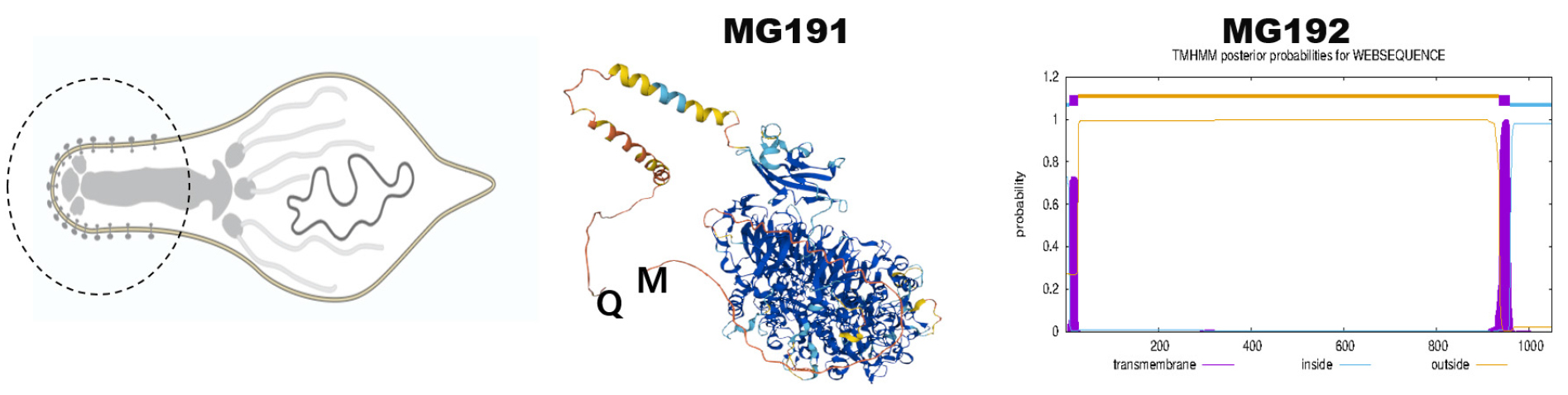
① M. genitalium의 형태학적 특징인 꼬리 부위
M. genitalium은 몸통과 빠져나온 꼬리 등의 단순한 형태를 보이는데 꼬리 부분이 M. genitalium의 숙주세포 내 침투, 항원 결정, 숙주 세포 내에서 운동 등 M. genitalium의 미생물학적인 특징에 관여한다 [그림 2]. 따라서 이러한 꼬리 부위의 단백질을 결정하는 유전자의 다양성은 M. genitalium이 비롯 제한된 유전자를 가진 미생물임에도 불구하고 숙주 내 다양한 장기내 침투가 가능해 구강, 직장, 남녀 생식기, 부고환, 전립선 등 다양한 장기에 침투 생존이 가능하다. 또한 꼬리 부위 유전자의 다양성은 M. genitalium의 운동에도 관여해 숙주 내 이동 속도를 결정하고, M. genitalium의 항원을 결정하는데 매우 중요한 역할을 한다.
② M. genitalium의 항원 결정
M. genitalium의 항원을 결정하는 부위는 MgPa adhesion로 명명되는데 MG190 (mgpA), MG191 (mgpB), MG192 (mgpC) 등 3개의 단백질로 구성되어 있다. 특이한 것은 이러한 MgPa 유전자와 유사한 염기서열를 가졌지만, 단백질을 생성하지 않는 9개의 MgPar 유전자가 M. genitalium genome에 골고루 분포되어 있다 [그림 3]. M. genitalium은 세균 중 크기와 구성 유전자 수가 가장 작고 매우 조밀한 미생물임에도 불구하고 이러한 MgPa 및 MgPar 유전자 수는 전체 유전자 수의 4.7%를 차지할 정도로 많았다.

그림 3.
M. genitalium의 MG191 (mgpB), MG192 (mgpC)와, MgPar의 염기서열 상동성. 균이 증식될 때 (F1) MG191/192부위와 다양한 MgPar부위의 유사 염기서열이 상호 교환 (recombination)이 일어나 F2에서는 다양한 염기서열을 가진 M. genitalium (F2_a/F2_b/F2_c)으로 재탄생하게 된다. 이는 F2의 M. genitalium의 표면 항원은 F1과 다르며 적절한 치료로 환자는 F1에 대한 항체를 가지고 있어도 성배우자가 동시에 치료받지 않거나 콘돔없이 성교시 새로운 감염인 F2 M. genitalium을 성배우자로부터 재감염 될 수 있다.
mgpB의 B, EF, G 부위와 mgpC의 KLM 부위는 MgPar 유전자의 유사한 염기 서열과 유전자 교환이 빈발하게 발생하고 변이 시점 또한 M. genitalium 감염 2주내 발생할 정도로 빠르고, 이러한 현상은 수년 동안 지속될 수 있어 적절한 대책이 없다면 변이가 무한대로 발생해 숙주 안에서 자가 면역을 회피해 만성 감염을 유발할 수 있다.
무증상 M. genitalium 감염의 경우 치료하지 않음이 원칙이다. 그러나 성배우자의 경우 증상의 유무 관계없이 감염자와 같이 M. genitalium 검사를 받거나 환자와 같은 항생제를 동시에 투여하는 등 적극적인 치료를 권유하고 있다. 또한 두 사람이 TOC 검사에서 완치가 확인될 때까지 콘돔 등을 사용해 상호 교차감염 예방이 강조되고 있다. 이는 환자만 치료하고 성배우자가 치료받지 않는다면 환자가 치료받고 완치되어 항체가 형성되었더라도 성배우자로부터 새롭게 변이된 M. genitalium에 의한 재감염 가능성이 이론상 무한대로 반복될 수 있다.
2.4. 증례로 본 32세 남자 환자의 추정되는 M. genitalium 만성 감염 기전
정리하자면 환자는 본원 3차 방문까지 동일한 유전자형과 동일한 항생제 내성을 보이는 M. genitalium의 재발이며, 4차 방문은 1-3차와 다른 증상과 다른 유전자형 및 다른 항생제 내성을 보이는 새로운 감염이다. 추적 병력 조사에서 환자는 1-3차 동안 한 여성과 콘돔 없이 성관계를 하고, 마지막 4차는 새로운 여성과 성관계를 하였다고 하였다. 저자의 생각으로는 F1 치료 후 양성은 TOC 검사를 조기에 시행해 검사의 위양성의 가능성으로 추정되었고, F2/F3의 치료 후 TOC 검사에서 음성인 것을 고려한다면 같은 성배우자로부터 MgPa 변이가 발생된 M. genitalium의 재감염으로 생각된다. 그리고 마지막 재발은 새로운 여성으로부터 감염된 새 감염으로 추정된다.
F1/F2/F3 방문 시 유전자형 조사와 항생제 내성 조사를 시행하지 않았다면 환자는 임상적인 치료 실패로 간주되어 moxifloxacin 사용 적응증이 될 수 있었으나, 저자의 경우 유전자 내성 검사로 azithromycin으로도 완치가 가능해 유전자 내성 검사가 M. genitalium 치료에 매우 중요함을 알 수 있었다.
3. 결론
본 논문에서 M. genitalium에 의한 재발/만성 감염의 기전에 관해 살펴보았다. M genitalium은 비교적 잘 알려진 항생제 내성뿐만 아니라 TOC 검사에서 낮은 민감도, 빠르며 지속적이고 제한 없이 발생하는 항원 변이 등으로 매우 다루기 힘든 성매개감염병이다. 따라서 M. genitalium의 치료와 전파 억제를 위해서는 M. genitalium의 미생물학적인 특징 이해와 진료/치료 가이드라인에 맞추어 진료함이 매우 중요하다. 이를 위해 의료인의 지속적인 교육과 관심, 우리나라의 M. genitalium의 항생제 내성 유전자 검사, 유전형 변이 등의 연구가 필요하다. 또한 성배우자의 적절한 진단과 치료 및 동반되는 법률적인 문제 등 또한 고려하여야만 한다. 이를 위해 항생제 치료에 저항하는 M. genitalium 감염의 경우 전문 의료기관에 보내 적절한 평가와 치료를 받게 해야 하며, 보건당국의 지속적인 관심과 지원이 요구된다.